题目内容
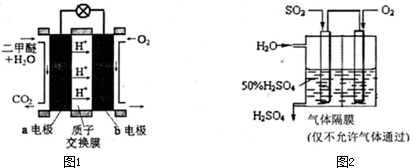
图1-2-24为持续电解饱和CaCl2水溶液的装置(以铂为电极),电解1 h后,将CO2连续通入电解液中,请完成有关各题:
图1-2-24
(1)电解时F极发生_________反应,电极反应式为__________________;E极发生反应,电极反应式为___________________________;
(2)电解时电解池中产生的现象是__________________,电解后持续通入CO2产生的现象是____________________________________________________________________。
解析:由题目所给图示知,F作阳极发生氧化反应,由于还原性Cl->OH-,所以电极反应为2Cl--2e-====Cl2↑,E极作阴极发生还原反应,由于H+的氧化性大于Ca2+,所以电极反应为2 H++2e-====H2↑,随着电解的不断进行,E极的附近碱性不断增强,生成Ca(OH)2,溶液呈红色,通入CO2时,发生反应Ca2++2H-+CO2====CaCO3↓+H2O,溶液变浑浊。持续通入CO2时,又发生反应CaCO3+CO2+H2O====Ca2++![]() ,所以先产生的白色沉淀又会溶解。
,所以先产生的白色沉淀又会溶解。
答案: (1)氧化 2Cl--2e-====Cl2↑
还原 2H++2e-====H2↑
(2)E极附近溶液变红色 溶液变浑浊,先产生白色沉淀,后沉淀溶解

练习册系列答案
相关题目
大气中的部分碘源于O3对海水中I-的氧化.将O3持续通入NaI溶液中进行模拟研究.
(1)O3将I-氧化成I2的过程由3步反应组成:
①I-(aq)+O3(g)=IO-(aq)+O2(g)△H1
②IO-(aq)+H+(aq)?HOI(aq)△H2
③HOI(aq)+I-(aq)+H+(aq)?I2(aq)+H2O(l)△H3
总反应的化学方程式为 ,其反应△H=
(2)在溶液中存在化学平衡:I2(aq)+I-(aq)?I3-(aq),其平衡常数表达式为 .
(3)为探究Fe2+对O3氧化I-反应的影响(反应体系如图1),某研究小组测定两组实验中I3-浓度和体系pH,结果见图2和下表.
第1组实验中,导致反应后pH升高的原因是 .
②图1中的A为 ,由Fe3+生成A的过程能显著提高Ⅰ-的转化率,原因是 .
③第2组实验进行18s后,I3-浓度下降.导致下降的直接原因有(双选) .
A.c(H+)减小 B.c(I-)减小 C.I2(g)不断生成 D.c(Fe3+)增加
(4)据图2,计算3-18s内第2组实验中生成I3-的平均反应速率(写出计算过程,结果保留两位有效数字).
(1)O3将I-氧化成I2的过程由3步反应组成:
①I-(aq)+O3(g)=IO-(aq)+O2(g)△H1
②IO-(aq)+H+(aq)?HOI(aq)△H2
③HOI(aq)+I-(aq)+H+(aq)?I2(aq)+H2O(l)△H3
总反应的化学方程式为 ,其反应△H=
(2)在溶液中存在化学平衡:I2(aq)+I-(aq)?I3-(aq),其平衡常数表达式为 .
(3)为探究Fe2+对O3氧化I-反应的影响(反应体系如图1),某研究小组测定两组实验中I3-浓度和体系pH,结果见图2和下表.

| 编号 | 反应物 | 反应前pH | 反应后pH |
| 第1组 | O3+I- | 5.2 | 11.0 |
| 第2组 | O3+I-+Fe2- | 5.2 | 4.1 |
②图1中的A为 ,由Fe3+生成A的过程能显著提高Ⅰ-的转化率,原因是 .
③第2组实验进行18s后,I3-浓度下降.导致下降的直接原因有(双选) .
A.c(H+)减小 B.c(I-)减小 C.I2(g)不断生成 D.c(Fe3+)增加
(4)据图2,计算3-18s内第2组实验中生成I3-的平均反应速率(写出计算过程,结果保留两位有效数字).