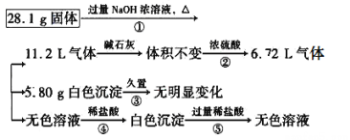题目内容
【题目】碱性锌锰电池的反应方程式为 2MnO2+Zn+2H2O===2MnOOH+Zn(OH)2,其构造如图所示。有关说法不正确的是( )

A.负极反应式:Zn+2OH--2e-===Zn(OH)2
B.放电时正极MnO2得到电子,发生氧化反应
C.该电池使用一段时间后,电解液pH增大
D.放电时,锌粉失去的电子,从负极通过外电路流向正极
【答案】B
【解析】
碱性锌锰电池的反应方程式为 2MnO2+Zn+2H2O===2MnOOH+Zn(OH)2,原电池中负极失电子发生氧化反应,所以Zn为负极,MnO2为正极。
A.Zn为负极,根据总反应可知Zn失电子生成Zn2+后与氢氧根结合生成氢氧化锌沉淀,所以电极方程式为Zn+2OH--2e-===Zn(OH)2,故A正确;
B.根据总反应可知MnO2化合价降低,得电子发生还原反应,为原电池正极,发生还原反应,故B错误;
C.根据总反应可知电池工作时会消耗水,而KOH没有被消耗,所以KOH浓度变大,电解液pH增大,故C正确;
D.放电时,锌为负极,失电子发生氧化反应,电子经外电路由负极流向正极,故D正确;
故答案为B。

练习册系列答案
相关题目