题目内容
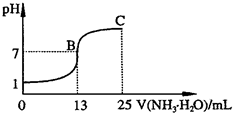
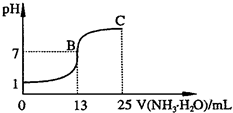
 常温下,向25mL 0.1mol?L-1 NaOH溶液中逐滴加入0.1 mol?L-1 CH3COOH溶液,曲线如图所示,有关粒子浓度关系正确的是( )
常温下,向25mL 0.1mol?L-1 NaOH溶液中逐滴加入0.1 mol?L-1 CH3COOH溶液,曲线如图所示,有关粒子浓度关系正确的是( )分析:A.根据溶液的电荷守恒判断;
B.B点时溶液pH=7,结合醋酸为弱电解质进行判断;
C.C点溶液呈酸性,醋酸过量;
D.D点n(CH3COOH)=2n(NaOH),从物料守恒的角度分析.
B.B点时溶液pH=7,结合醋酸为弱电解质进行判断;
C.C点溶液呈酸性,醋酸过量;
D.D点n(CH3COOH)=2n(NaOH),从物料守恒的角度分析.
解答:解:A.A到D之间溶液中都存在Na+、H+、CH3COO-、OH-等离子,根据溶液的电荷守恒可知都存在c(Na+)+c(H+)=c(CH3COO-)+(OH-),故A错误;
B.B点时溶液pH=7,则c(OH-)=c(H+),因醋酸为弱酸,则a>25,根据溶液的电荷守恒可知c(Na+)+c(H+)=c(CH3COO-)+(OH-),则c(Na+)=c(CH3COO-)>c(OH-)=c(H+),故B正确;
C.C点溶液呈酸性,醋酸过量,溶液呈酸性,存在c(CH3COO-)>c(Na+)>c(H+)>c(OH-),故C正确;
D.D点n(CH3COOH)=2n(NaOH),根据物料守恒可知c(CH3COO-)+c(CH3COOH)=2c(Na+),故D错误.
故选BC.
B.B点时溶液pH=7,则c(OH-)=c(H+),因醋酸为弱酸,则a>25,根据溶液的电荷守恒可知c(Na+)+c(H+)=c(CH3COO-)+(OH-),则c(Na+)=c(CH3COO-)>c(OH-)=c(H+),故B正确;
C.C点溶液呈酸性,醋酸过量,溶液呈酸性,存在c(CH3COO-)>c(Na+)>c(H+)>c(OH-),故C正确;
D.D点n(CH3COOH)=2n(NaOH),根据物料守恒可知c(CH3COO-)+c(CH3COOH)=2c(Na+),故D错误.
故选BC.
点评:本题综合考查离子浓度大小比较,题目难度不大,注意结合物料守恒以及电荷守恒解答该题,易错点为A,注意A到D之间溶液中都存在Na+、H+、CH3COO-、OH-等离子,从电荷守恒的角度解答该题.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
 (2011?青岛模拟)氮的化合物在某些领域中扮演着重要的角色.
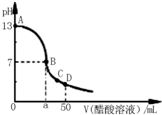
(2011?青岛模拟)氮的化合物在某些领域中扮演着重要的角色.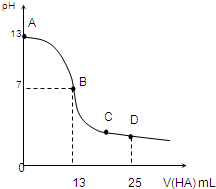 常温下,向25mL 0.1mol/L MOH溶液中逐滴加入0.2mol/L HA溶液,曲线如图所示(体积变化忽略不计).回答下列问题:
常温下,向25mL 0.1mol/L MOH溶液中逐滴加入0.2mol/L HA溶液,曲线如图所示(体积变化忽略不计).回答下列问题: