题目内容
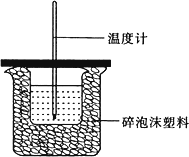
50.00 mL 0.50 mol/L盐酸跟50.0 mL 0.55 mol/L氢氧化钠溶液在下图装置中进行中和反应,通过测定反应前盐酸和氢氧化钠溶液各自的温度和中和过程中混合液的最高温度可计算中和热.试回答下列问题.
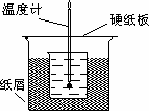
(1)该实验装置设计中缺少的仪器的名称为________.
(2)若实验测得放出热量为1.43 kJ,写出表示中和热的热化学方程式________.
(3)改用60.0 mL 0.5 mol/L盐酸跟50.0 mL 0.55 mol/L氢氧化钠溶液进行反应,与上述实验相比,所放热量________等,所求中和热数值________等.(填“相等,不相等”)
答案:
解析:
解析:
|
(1)略 (2)略 57.2kJ/mol (3)不 相■(答案对不上) |

练习册系列答案
相关题目