题目内容
【题目】氨基甲酸铵(NH2COONH4)是一种易分解、易水解的白色固体、难溶于CCl4。实验室可将干燥二氧化碳和氨气通入CCl4中进行制备,反应原理为2NH3(g)+CO2(g)=NH2COONH4(s) △H<0,回答下列问题:
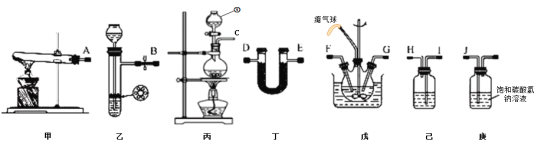
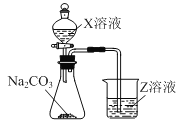
(1)仪器①的名称为_____,装置己中盛放的试剂为_____。
(2)简述检验装置乙气密性的操作_____。
(3)氨气的发生装置可以选择上图中的_____,制取氨气的化学方程式为_____。
(4)预制备产品,选择上图中必要的装置,其连接顺序为:发生装置→_____→FG←_____←KJ←_____(按气流方向,用大写字母表示)。
(5)为了提高氨基甲酸铵的产率.对三颈瓶采取的控温方法是_____,反应结束后,从反应后的混合物中分离出产品的实验操作是_____,戊中气球的作用是_____。
(6)氨基甲酸铵容易变质生成碳酸氢铵,现取长期存放的样品19.550g,用足量石灰水处理后,使样品中碳元素完全转化为碳酸钙,通过系列操作得纯净碳酸钙25.000g,则该样品的纯度为_____%。(计算结果保留三位有效数字;有关物质的相对式量:氨基甲酸铵78、碳酸氢铵79、碳酸钙100) 。
【答案】分液漏斗 浓硫酸 夹紧止水夹,从长颈漏斗加水至漏斗内液面高于试管内液面,静置,若液面保持不变,说明气密性良好 甲或丙 2NH4Cl+Ca(OH)2![]() CaCl2+2NH3↑+2H2O或NH3·H2O
CaCl2+2NH3↑+2H2O或NH3·H2O![]() NH3↑+H2O DE(或ED) HI B 冷水浴 过滤 平衡压强,收集尾气 79.8
NH3↑+H2O DE(或ED) HI B 冷水浴 过滤 平衡压强,收集尾气 79.8
【解析】
用甲或丙制取氨气,用碱石灰干燥后通入CCl4中,用乙装置制取二氧化碳气体,用碳酸氢钠除去二氧化碳中的氯化氢,用浓硫酸干燥后通入CCl4中,在三颈瓶中搅拌发生反应2NH3(g)+CO2(g)=NH2COONH4(s) 。
(1)根据图示,仪器①是分液漏斗,装置己用于干燥二氧化碳,盛放的试剂为浓硫酸;
(2)检验装置乙气密性的操作是:夹紧止水夹,从长颈漏斗加水至漏斗内液面高于试管内液面,静置,若液面保持不变,说明气密性良好;
(3)实验室用加热氯化铵、氢氧化钙固体混合物或加热浓氨水的的方法制取氨气,所以氨气的发生装置可以选择上图中的甲或丙,制取氨气的化学方程式为2NH4Cl+Ca(OH)2![]() CaCl2+2NH3↑+2H2O或NH3·H2O
CaCl2+2NH3↑+2H2O或NH3·H2O![]() NH3↑+H2O;
NH3↑+H2O;
(4) 用甲或丙制取氨气,用碱石灰干燥后通入CCl4中,用乙装置制取二氧化碳气体,用碳酸氢钠除去二氧化碳中的氯化氢,用浓硫酸干燥后通入CCl4中,氨气、二氧化碳在三颈瓶中反应生成氨基甲酸铵,其连接顺序为:发生装置→DE→FG←HI←KJ←B ;
(5)正反应放热,为了提高氨基甲酸铵的产率,对三颈瓶采取的控温方法是冷水浴,氨基甲酸铵难溶于CCl4,反应结束后,从反应后的混合物中分离出产品的实验操作是过滤,戊中气球的作用是平衡压强,收集尾气;
(6) 通过系列操作得纯净碳酸钙25.000g,则样品中碳元素的物质的量为![]() ,设样品中氨基甲酸铵的质量为xg,
,设样品中氨基甲酸铵的质量为xg,![]() ,x=0.2mol,则该样品的纯度为
,x=0.2mol,则该样品的纯度为![]() 79.8%。
79.8%。

 名校课堂系列答案
名校课堂系列答案【题目】某化学实验小组用酸性KMnO4溶液和草酸(H2C2O4)溶液反应,研究外界条件反应速率的影响,设计了如下探究实验方案:
实验 | 草酸溶液 (0.5mol/L) | 高锰酸钾 (0.5mol/L) | 稀硫酸 (0.5mol/L) | 硫酸锰 (0.5mol/L) | 温度 | 蒸馏水 |
① | 10.0 mL | 2.0 mL | 3.0 mL | 0 | 25℃ | 1.0 mL |
② | 10.0 mL | 2.0 mL | 3.0 mL | 1.0 mL | 25℃ | 0 |
③ | 8.0 mL | 2.0 mL | 3.0 mL | 0 | 25℃ | Vx |
④ | 10.0 mL | 2.0 mL | 3.0 mL | 0 | 35℃ | 1.0 mL |
回答下列问题:
(1)本方案中用于设计实验的化学反应的离子方程式是____,实验中预计通过观察什么现象或测定什么数据来进行判断:_____。
(2)该实验的目的是____。
(3)实验③中的Vx=____;实验①和④测得反应速率分别为v1、v4,则v1____v4(填:“>”“<”和“=”)
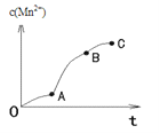
(4)实验①中,c(Mn2+)与t关系如图所示。AB段斜率明显大于OA段斜率,除反应可能放热外,猜想还可能是_____,利用提供的试剂设计实验III,验证猜想。
提供的试剂:0.01mol/L酸性KMnO4溶液,0.1 mol/L草酸溶液,3mol/L硫酸,MnSO4溶液,MnSO4固体,蒸馏水
①补全实验III的操作:向试管中先加入1mL 0.01mol/L酸性KMnO4溶液,再加入10滴3mol/L硫酸,然后加入少量的____,最后加入1mL 0.1 mol/L草酸溶液。
②若猜想成立,应观察到的实验现象是_______。