题目内容
 由于Fe (OH)2极易被氧化,所以实验室很难用亚铁盐溶液与烧碱反应制得白色纯净的Fe (OH)2沉淀,应用如图电解实验可以制得白色的纯净的Fe (OH)2沉淀.两电极材料分别为石墨和铁.
由于Fe (OH)2极易被氧化,所以实验室很难用亚铁盐溶液与烧碱反应制得白色纯净的Fe (OH)2沉淀,应用如图电解实验可以制得白色的纯净的Fe (OH)2沉淀.两电极材料分别为石墨和铁.(1)b电极材料应为
Fe
Fe
,电极反应式为Fe-2e-=Fe2+
Fe-2e-=Fe2+
.(2)电解液C可以是
BC
BC
.A.纯净水 B.NaCl溶液 C.NaOH溶液 D.CuCl2溶液
(3)d为苯,其作用是
隔绝空气防止氢氧化亚铁被氧化
隔绝空气防止氢氧化亚铁被氧化
,在加入苯之前对C应作何简单处理加热煮沸
加热煮沸
(4)为了在较短时间内看到白色沉淀,可采取的措施是
BC
BC
.A.改用稀硫酸作电解液 B.适当增大电源的电压.
C.适当减小两电极间距离 D.适当降低电解液的温度.
(5)若C中用Na2SO4溶液,当电解一段时间看到白色Fe (OH)2沉淀后,再反接电源电解,除了电极上看到气泡外,混合物中另一明显现象为
白色沉淀迅速变为灰绿色,最终变为红褐色
白色沉淀迅速变为灰绿色,最终变为红褐色
.分析:(1)制纯净的Fe(OH)2沉淀,则Fe为阳极,失去电子,b与电源正极相连,则b为阳极;
(2)纯水导电性太差,影响物质的制备,而NaCl、NaOH溶液中氢离子放电,可生成Fe(OH)2沉淀,电解液为CuCl2溶液,发生Fe+CuCl2=Cu+CuCl2;
(3)苯的密度水的小,不溶于水,可隔绝空气,防止氢氧化亚铁被氧化,并在实验之前对溶液煮沸,排出溶液中的氧气;
(4)短时间内看到白色沉淀,增大反应的速率即可;
(5)反接电源时,电解方程式是2H2O
2H2↑+O2↑,生成的O2会将Fe(OH)2氧化.
(2)纯水导电性太差,影响物质的制备,而NaCl、NaOH溶液中氢离子放电,可生成Fe(OH)2沉淀,电解液为CuCl2溶液,发生Fe+CuCl2=Cu+CuCl2;
(3)苯的密度水的小,不溶于水,可隔绝空气,防止氢氧化亚铁被氧化,并在实验之前对溶液煮沸,排出溶液中的氧气;
(4)短时间内看到白色沉淀,增大反应的速率即可;
(5)反接电源时,电解方程式是2H2O
| ||
解答:解:(1)制纯净的Fe(OH)2沉淀,则Fe为阳极,失去电子,b与电源正极相连,则b为阳极,发生的电极反应为Fe-2e-=Fe2+,
故答案为:Fe;Fe-2e-=Fe2+;
(2)纯水导电性太差,影响物质的制备,而NaCl、NaOH溶液中氢离子放电,可生成Fe(OH)2沉淀,电解液为CuCl2溶液,发生Fe+CuCl2=Cu+CuCl2,
则电解液b可选择BC,故答案为:BC;
(3)苯的密度水的小,不溶于水,可隔绝空气,防止氢氧化亚铁被氧化,为防止氢氧化亚铁被氧化,并在实验加入苯之前,对d溶液进行加热煮沸的目的是排出溶液中的氧气,
故答案为:隔绝空气防止氢氧化亚铁被氧化;加热煮沸;
(4)短时间内看到白色沉淀,适当增大电源电压、适当缩小两电极间距离可增大反应的速率,而改用稀硫酸不能生成沉淀,降低温度反应速率减慢,故答案为:BC.
(5)反接电源时,电解方程式是2H2O
2H2↑+O2↑,生成的O2会将Fe(OH)2氧化,其现象是白色沉淀迅速变为灰绿色,最终变为红褐色,故答案为:白色沉淀迅速变为灰绿色,最终变为红褐色.
故答案为:Fe;Fe-2e-=Fe2+;
(2)纯水导电性太差,影响物质的制备,而NaCl、NaOH溶液中氢离子放电,可生成Fe(OH)2沉淀,电解液为CuCl2溶液,发生Fe+CuCl2=Cu+CuCl2,
则电解液b可选择BC,故答案为:BC;
(3)苯的密度水的小,不溶于水,可隔绝空气,防止氢氧化亚铁被氧化,为防止氢氧化亚铁被氧化,并在实验加入苯之前,对d溶液进行加热煮沸的目的是排出溶液中的氧气,
故答案为:隔绝空气防止氢氧化亚铁被氧化;加热煮沸;
(4)短时间内看到白色沉淀,适当增大电源电压、适当缩小两电极间距离可增大反应的速率,而改用稀硫酸不能生成沉淀,降低温度反应速率减慢,故答案为:BC.
(5)反接电源时,电解方程式是2H2O
| ||
点评:本题考查氢氧化亚铁的制备和电解原理,明确电解原理及Fe为阳极是解答本题的关键,注意实验中防止氢氧化亚铁被氧化,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
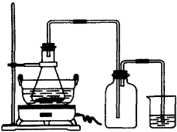 绿矾(FeSO4?7H2O)是重要的化学化工试剂,工业上常利用机械加工行业产生的废铁屑为原料制备.
绿矾(FeSO4?7H2O)是重要的化学化工试剂,工业上常利用机械加工行业产生的废铁屑为原料制备.请回答下列问题:
(1)图是某研究性学习小组用于制备绿矾的装置,其中集气瓶的作用是
(2)如图锥形瓶中的反应物是铁屑和28%的硫酸,反应前常用98%的硫酸配制500g 28%的硫酸,要算出所需98%的硫酸的体积,还要知道的数据是
(3)在制备硫酸亚铁的过程中,理论上控制铁过量或酸过量均有利于防止Fe2+被氧化.设计两个实验:实验一,控制酸过量;实验二,控制铁过量;其余步骤同,制得硫酸亚铁,并对产品质量进行检测.检测结果如下:
| 序号 | 反应物用量 | 产品质量 |
| 1 | n(H2SO4):n(Fe)>1:1 | 介于Ⅰ级~Ⅱ级之间 |
| 2 | n(H2SO4):n(Fe)<1:1 | 优于Ⅰ级 |
(4)该小组在继续研究由绿矾制备Fe(OH)2的过程中,发现出现白色的沉淀会逐渐转变为灰绿色,最后变为红褐色.甲同学查资料该灰绿色沉淀可能是Fe3(OH)8,请用氧化物的形式写出该沉淀
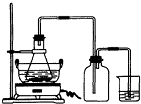 (2009?广东模拟)绿矾(FeSO4?7H2O)是重要的化学化工试剂,工业上常利用机械加工行业产生的废铁屑为原料制备.请回答下列问题:
(2009?广东模拟)绿矾(FeSO4?7H2O)是重要的化学化工试剂,工业上常利用机械加工行业产生的废铁屑为原料制备.请回答下列问题: 某研究性学习小组在研究由Fe2+制备Fe(OH)2的过程中,设计了如下实验方案:
某研究性学习小组在研究由Fe2+制备Fe(OH)2的过程中,设计了如下实验方案: Ⅰ.用标准NaOH溶液滴定未知浓度的盐酸,用酚酞作指示剂,下列操作中会导致实验结果偏低的是
Ⅰ.用标准NaOH溶液滴定未知浓度的盐酸,用酚酞作指示剂,下列操作中会导致实验结果偏低的是