题目内容
有下列6种物质:Na2SO4、Na2SO3、K2SO4、I2、H2SO4、KIO3组成一个氧化还原反应,请回答下列问题:
(1)将这6种物质分别填入下面对应的横线上,组成一个未配平的化学方程式:
______+Na2SO3+______→______+______+______+H2O
(2)反应物中发生氧化反应的物质是______(填化学式),被还原的元素是______.
(3)反应中1mol氧化剂______(填“得到”或“失去”)______mol电子.
(4)请将反应物的化学式及配平后的系数填入下列相应的位置中:
____________+____________+____________→
(1)Na2SO3 是反应物,H2O是生成物,根据原子守恒,知硫酸是反应物,硫酸钠是生成物,根据化合价的变化判断亚硫酸钠是还原剂;另一种反应物是氧化剂,化合价的变化是由高变低,所以KIO3是氧化剂,还原产物是I2;
故答案为:KIO3;H2SO4 ;Na2SO4;I2; K2SO4;
(2)根据化合价变化知,还原剂是Na2SO3 ,还原剂发生氧化反应,氧化剂发生还原反应,被还原;
故答案为:Na2SO3 ,I;
(3)氧化还原反应中,得电子的物质是氧化剂,设得电子的物质的量是x,
2 KIO3 +5 Na2SO3 +H2SO4 =5 Na2SO4 +I2+K2SO4+H2O 转移电子
2mol 10mol
1mol x
x= =5mol,
=5mol,
故答案为:得到;5;
(4)该反应中碘元素化合价由+5价变为0价,S元素化合价由+4价变为+6价,所以得失电子最小公倍数是10,则
KIO3 的计量数是2,Na2SO3的计量数是5,再根据原子守恒配平即可,所以该反应方程式为:2 KIO3 +5 Na2SO3 +H2SO4 =5 Na2SO4 +I2+K2SO4+H2O,故答案为:2,KIO3 ,5,Na2SO3 ,1,H2SO4 .
分析:(1)先根据亚硫酸钠和水结合原子守恒判断反应物,及亚硫酸钠是氧化剂还是还原剂;再根据化合价的变化确定氧化剂及还原产物;
(2)根据还原剂发生氧化反应从而确定发生氧化反应的物质;根据化合价变化判断被还原的元素;
(3)根据氧化剂的定义判断得失电子,结合方程式计算转移电子数;
(4)根据得失电子数相等配平方程式.
点评:本题考查氧化还原反应,明确元素化合价是解本题关键,根据元素化合价变化来分析解答即可,根据得失相等进行配平即可,难度中等.
故答案为:KIO3;H2SO4 ;Na2SO4;I2; K2SO4;
(2)根据化合价变化知,还原剂是Na2SO3 ,还原剂发生氧化反应,氧化剂发生还原反应,被还原;
故答案为:Na2SO3 ,I;
(3)氧化还原反应中,得电子的物质是氧化剂,设得电子的物质的量是x,
2 KIO3 +5 Na2SO3 +H2SO4 =5 Na2SO4 +I2+K2SO4+H2O 转移电子
2mol 10mol
1mol x
x=
 =5mol,
=5mol,故答案为:得到;5;
(4)该反应中碘元素化合价由+5价变为0价,S元素化合价由+4价变为+6价,所以得失电子最小公倍数是10,则
KIO3 的计量数是2,Na2SO3的计量数是5,再根据原子守恒配平即可,所以该反应方程式为:2 KIO3 +5 Na2SO3 +H2SO4 =5 Na2SO4 +I2+K2SO4+H2O,故答案为:2,KIO3 ,5,Na2SO3 ,1,H2SO4 .
分析:(1)先根据亚硫酸钠和水结合原子守恒判断反应物,及亚硫酸钠是氧化剂还是还原剂;再根据化合价的变化确定氧化剂及还原产物;
(2)根据还原剂发生氧化反应从而确定发生氧化反应的物质;根据化合价变化判断被还原的元素;
(3)根据氧化剂的定义判断得失电子,结合方程式计算转移电子数;
(4)根据得失电子数相等配平方程式.
点评:本题考查氧化还原反应,明确元素化合价是解本题关键,根据元素化合价变化来分析解答即可,根据得失相等进行配平即可,难度中等.

练习册系列答案
 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案
相关题目





 +(n-1)H2O
+(n-1)H2O
 或
或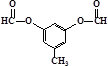
 与G互为同分异构体
与G互为同分异构体




 2s
2s 3s
3s 4s
4s ,则该元素基态原子的电子排布式为 ;其最高价氧化物对应的水化物的化学式是
,则该元素基态原子的电子排布式为 ;其最高价氧化物对应的水化物的化学式是 
 2s
2s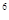 3s
3s 4s
4s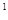 ,则该元素基态原子的电子排布式为
;其最高价氧化物对应的水化物的化学式是
,则该元素基态原子的电子排布式为
;其最高价氧化物对应的水化物的化学式是