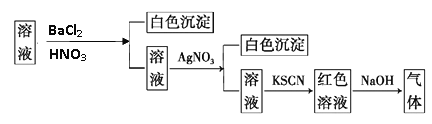
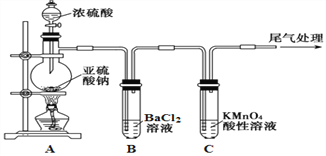
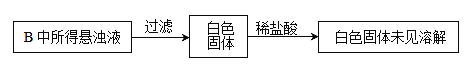
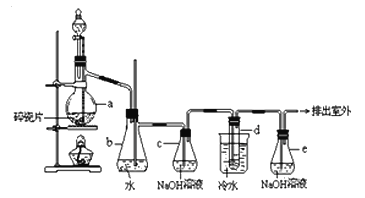
题目内容
【题目】下表是元素周期表的一部分,除标出的元素外,表中的每个编号都代表一种元素,请根据要求回答问题:
族 周期 | IA | 0 | |||||||
1 | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |||
2 | ① | ② | Ne | ||||||
3 | ③ | ④ | ⑤ | ⑥ | |||||
(1)元素①的最低价氢化物和最高价氧化物的水化物反应得到一种离子化合物的化学式为________________;
(2)②和⑥两种元素的原子半径大小关系:②________⑥(填“>”或“<”);
(3)③和⑤两种元素的金属性强弱关系:③________⑤(填“>”或“<”),它们的最高价氧化物对应水化物反应的离子方程式为__________________________________________;
(4)④的单质与⑥的最高价氧化物对应的水化物的稀溶液反应的离子方程式:________________________________。
【答案】 NH4NO3 < > OH-+Al(OH)3===AlO![]() +2H2O Mg+2H+===Mg2++H2↑
+2H2O Mg+2H+===Mg2++H2↑
【解析】根据元素在周期表中的相对位置可知①~⑥分别是N、F、Na、Mg、Al、S。则
(1)N元素的最低价氢化物氨气和最高价氧化物的水化物硝酸反应离子化合物硝酸铵,化学式为NH4NO3;(2)同周期自左向右原子半径逐渐减小,同主族从上到下原子半径逐渐增大,则②和⑥两种元素的原子半径大小关系:②<⑥;(3)同周期自左向右金属性逐渐减弱,则③和⑤两种元素的金属性强弱关系:③>⑤(填“>”或“<”),氢氧化铝是两性氢氧化物,它们的最高价氧化物对应水化物反应的离子方程式为 OH-+Al(OH)3=AlO![]() +2H2O;(4)④的单质与⑥的最高价氧化物对应的水化物的稀溶液稀硫酸反应的离子方程式为Mg+2H+=Mg2++H2↑。
+2H2O;(4)④的单质与⑥的最高价氧化物对应的水化物的稀溶液稀硫酸反应的离子方程式为Mg+2H+=Mg2++H2↑。

 学习实践园地系列答案
学习实践园地系列答案【题目】下列物质除杂(括号内物质为杂质)所用试剂正确的是( )
物 质 | 试 剂 | |
A | Na2SO4溶液(NaBr) | Cl2 |
B | KNO3(NaCl) | AgNO3溶液 |
C | Cl2(HCl) | 饱和食盐水 |
D | CO2(HCl) | 饱和Na2CO3溶液 |
A.A
B.B
C.C
D.D
【题目】下列化学实验操作、现象及结论均正确的是
选项 | 实验操作 | 实验现象 | 结论 |
A | 取1 mL 20%的蔗糖溶液,加入3~5滴稀硫酸,水浴加热一段时间后,再滴加银氨溶液 | 没有出现银镜 | 蔗糖没有水解 |
B | 锅炉中的水垢用饱和碳酸钠溶液浸泡后,再加入稀盐酸 | 水垢明显减少 | 锅炉沉积物中的CaSO4转化为CaCO3 |
C | 常温下,在0.1 mol·L1氨水中,加入少量NH4Cl晶体 | 溶液的pH减小 | NH4Cl溶液显酸性 |
D | 向饱和Na2CO3溶液中通入足量CO2 | 溶液变浑浊 | NaHCO3为难溶物 |