题目内容
下列有关说法正确的是
| A.25oC与60oC时,纯水的pH相等 |
| B.CaCO3难溶于稀硫酸,也难溶于醋酸 |
| C.电解法精炼铜时,以粗铜作阴极,纯铜作阳极 |
| D.反应NH3(g)+HCl(g)=NH4Cl(s)在室温下可自发进行,则该反应的△H<0 |
D
解析试题分析:A、水的电离吸热,加热促进电离,则25oC与60oC时,纯水的pH不相等,前者大,A不正确;B、硫酸钙微溶,因此CaCO3难溶于稀硫酸,但溶于醋酸,B不正确;C、电解法精炼铜时,以粗铜作阳极,纯铜作阴极,硫酸铜溶液作电解液,C不正确;D、根据△G=△H-T·△S可知,若反应NH3(g)+HCl(g)=NH4Cl(s)在室温下可自发进行,由于该反应的熵值减小,则该反应一定是放热反应,即△H<0,D正确,答案选D。
考点:考查水的电离、溶解平衡、粗铜精炼以及反应自发性应用

练习册系列答案
 举一反三期末百分冲刺卷系列答案
举一反三期末百分冲刺卷系列答案
相关题目
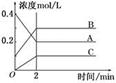
一定条件下存在反应:C(s)+H2O(g) CO(g)+H2(g)△H>0。向甲、乙、丙三个恒容容器中加入一定量C和H2O,各容器中温度、反应物的起始量如下表,反应过程中CO的物质的量浓度随时间变化如图所示。
CO(g)+H2(g)△H>0。向甲、乙、丙三个恒容容器中加入一定量C和H2O,各容器中温度、反应物的起始量如下表,反应过程中CO的物质的量浓度随时间变化如图所示。
| 容器 | 甲 | 乙 | 丙 |
| 容积 | 0.5 L | 0.5 L | V |
| 温度 | T1 ℃ | T2 ℃ | T1 ℃ |
| 起始量 | 2 molC 1 molH2O | 1 molCO 1 molH2 | 4 molC 2 molH2O |
A.甲容器中,反应在前15 min的平均速率v(H2)="0.1" mol·L-1·min-1
B.丙容器的体积V<0.5 L
C.当温度为T1 ℃时,反应的平衡常数K=2.25
D.乙容器中,若平衡时n(H2O)="0.4" mol,则T1< T2
某温度下,对可逆反应2X(g) + Y(g) 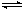 3Z(g) + W(s) ΔH>0 的叙述正确的是
3Z(g) + W(s) ΔH>0 的叙述正确的是
| A.加入少量W,逆反应速率增大,平衡向左移动 |
| B.增大压强,正反应速率增大,逆反应速率减小 |
| C.温度、体积不变,充入He气增大压强,反应速率会加快 |
| D.升高温度,混合气体的平均相对分子质量减小 |
纳米是长度单位,1纳米等于1×10-9米,物质的颗粒达到纳米级时,具有特殊的性质。例如将单质铜制成“纳米铜”时,具有非常强的化学活性,在空气中可以燃烧。下列对“纳米铜” 的有关叙述正确的是( )
| A.常温下“纳米铜”比铜片的还原性强,反应时反应速率快 |
| B.“纳米铜”颗粒更细小,化学反应时接触面大,所以反应速率快 |
| C.“纳米铜”与铜是同素异形体 |
| D.常温下“纳米铜”比铜片更易得电子,反应时反应速率快 |
2SO2+O2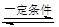 2SO3是工业上制硫酸的反应。下列关于该反应的说法正确的是( )
2SO3是工业上制硫酸的反应。下列关于该反应的说法正确的是( )
| A.减少O2的浓度能加快反应速率 |
| B.降低体系温度能加快反应速率 |
| C.使用催化剂不影响反应速率 |
| D.一定条件下达到反应限度时SO2部分转化为SO3 |
 N2O4△H<0)下列叙述正确的是
N2O4△H<0)下列叙述正确的是
 2B(g)+C(g)
2B(g)+C(g)