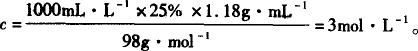题目内容
实验欲配制6 mol·L-1的H2SO4溶液.现有三种不同浓度的硫酸:①240 mL 1 mol·L-1的硫酸;②150 mL 25%的硫酸(ρ=1.18 g·mL-1);③足量的18 mol·L-1的浓H2SO4.现有三种规格容量瓶:250 mL、500 mL、1000 mL.配制要求:①、②两种硫酸全部用完,不足部分由③补充.问需要多少毫升浓H2SO4?
答案:295mL
解析:
解析:
|
解答:依题意关键是确定配制6 mol·L-1硫酸溶液的体积,其体积只有三个数值可选择:250 mL、500 mL、1000 mL,计算时只要在欲配制的体积范围内,各种浓度硫酸混合不必考虑体积变化.首先求出②的硫酸溶液的物质的量浓度,然后依据所配制的溶液中溶质的物质的量等于所需三种硫酸溶液中溶质的物质的量之和即可求出浓H2SO4的体积. 150 mL 25% H2SO4溶液物质的量浓度: 确定配制6 mol·L-1硫酸溶液的体积; 因为①、②两溶液体积和约为240 mL+150 mL=390 mL的浓度又都小于6 mol·L-1,所以不能选用250 mL容量瓶. 设配制500 mL,所需浓H2SO4体积为x,0.5 L×6 mol·L-1=0.24 L×1 mol·L-1+0.15 L×3 mol·L-1+x/1000 mL·L-1×18 mol·L-1,x=128.3 mL. 因为128.3+240+150>500,所以500 mL容量瓶也不能选用. 设配制1000 mL,需浓H2SO4体积为y. 1 L×6 mol·L-1=0.24 L×1 mol·L-1+0.15 L×3 mol·L-1+y/1000 mL·L-1×18 mol·L-1,y=295 mL. |

练习册系列答案
 心算口算巧算一课一练系列答案
心算口算巧算一课一练系列答案
相关题目