��Ŀ����
����Ŀ���⼰�仯����������������Ӧ�ù㷺���ش���������:
��1�����ʵ������Ӧ�ɵ�IF5��ʵ�����Һ̬IF5����һ���ĵ�����ԭ������IF5����ż���루��:2H2O![]() H3O++OH-����IF5����ż���뷽��ʽΪ_________
H3O++OH-����IF5����ż���뷽��ʽΪ_________
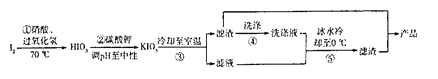
��2���������ƺ͵������������Һ�еķ�Ӧ��:Na2SO3+KIO3+H2SO4 ��Na2SO4+K2SO4+I2+H2O��δ��ƽ���÷�Ӧ���̺ͻ����ϸ��ӣ�һ����Ϊ��Ϊ���²�:
��IO3-+SO32-��IO2-+SO42-������
��IO2-+SO32-��IO-+SO42-���죩
��5I-+6H++I03-��3I2+3H2O���죩
��I2+SO32-+H2O-��2I+SO42-+2H+���죩
�������������Ʋ⣬�˷�Ӧ���ܷ�Ӧ������_______����Ӧ����������ţ�����Ԥ�ȼ��˵�����Һ��������������_____________����������ʱ���Ż��е��۱��������������
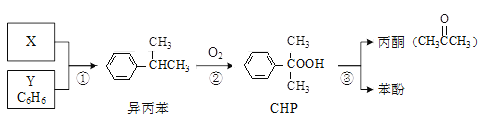
��3�����ӵ���������Ҫ���о�����
����֪SO2��I2�ķ�Ӧ�����ʼ�����ƽ�ⳣ������Һ�д�������ƽ��:I2(aq)+l-(aq)=l3-(aq)�ֽ�1 mol SO2��ͨ�뺬1mol l2��ˮ��Һ����ǡ����ȫ��Ӧ��Һ��l3-�����ʵ���n(l3-)ʱ�䣨t���ı仯������ͼ1��ʾ����ʼ�Σ�n(l3-)�������ԭ����_____
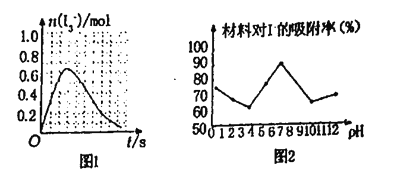
�ڿ���С�������Ͳ���Ag/TiO2����Һ�е����ӽ��������о�����ͼ2�Dz�ͬpH�����£�����������Ч���ı仯���ߡ��ݴ��ƶ�Ag/TiO2�������ʺ�����___________����������������������������������Һ�е�I-��
���Ȼ�������������Ҳ����Ч�����������Ȼ��������������Ե����ӵ�������ӦΪ:I-(aq)+AgCl(s)=Agl(s)+Cl-(aq)����Ӧ�ﵽƽ�����Һ��c(Cl-)=1.0mol��L-1.����Һ��c(I-)=______mol��L-1��k(AgCl)=2.0��10-10��k(Agl)=8.4��10-17��
��4��Fe3+��I-����Һ�з�����Ӧ:2Fe3++2I- ![]() 2Fe2++I2���÷�Ӧ������Ӧ���ʺ�Fe2+��I-��Ũ�ȹ�ϵΪv=k��cm(I-)��cn(Fe3+)������kΪ��������T��ʱ��ʵ����c��I-����c��Fe3+���뷴Ӧ���ʵĹ�ϵ���±���
2Fe2++I2���÷�Ӧ������Ӧ���ʺ�Fe2+��I-��Ũ�ȹ�ϵΪv=k��cm(I-)��cn(Fe3+)������kΪ��������T��ʱ��ʵ����c��I-����c��Fe3+���뷴Ӧ���ʵĹ�ϵ���±���
c��I-��/molL-1 | c��Fe3+��/molL-1 | v/molL-1s-1 | |
�� | 0.20 | 0.80 | 0.032k |
�� | 0.60 | 0.40 | 0.144k |
�� | 0.80 | 0.20 | 0.128k |
����v=k��cm(I-)��cn(Fe3+)��m��n��ֵΪ_____________������ţ�
A.m=1n=1 B.m=1��n=2 C.m=2��n=1 D.m=2��n=2
��I-Ũ�ȶԷ�Ӧ���ʵ�Ӱ��_____����������������С����������������Fe3+Ũ�ȶԷ�Ӧ���ʵ�Ӱ�졣
���𰸡�![]() ��
�� ![]() ��ʼ�Σ�SO2��I2��Ӧ���ɵ�I-��Ũ�Ȳ�������
��ʼ�Σ�SO2��I2��Ӧ���ɵ�I-��Ũ�Ȳ�������![]() �ķ�Ӧƽ�������ƶ���
�ķ�Ӧƽ�������ƶ���![]() �������� ���� 4.2��10-7 C ����
�������� ���� 4.2��10-7 C ����
��������
��1������ˮ����ż�����������뷽��ʽ��
��2�������ܷ�Ӧ����ȡ���������ķ�Ӧ���������ݵ���������������Է������ⵥ�ʴ��ڲű��������͵ⵥ�ʷ�Ӧ�����������꼴�ɡ�
��3�����ݷ�Ӧ��Ũ������Ӧ���ʼӿ���з�����
��4������ƽ�ⳣ���ļ��㹫ʽ���������Ũ�ȡ�
(1)����ˮ����ż�������������뷽��ʽΪ��2IF5![]() IF4++IF6-��
IF4++IF6-��
(2).��Ӧ�������ʴ������ķ�Ӧ���������Դ˷�Ӧ���ܷ�Ӧ�����ɢٲ���Ӧ����Ϊ������������ܷ�Ӧ���ĵⵥ�ʣ���������������������꣬�ⵥ�ʴ��ڣ��Ż��е��۱�������������
(3) �ٿ�ʼ�Σ�����SO2��I2��Ӧ�����ɵ�I-��Ũ�Ȳ�������![]() �ķ�Ӧƽ�������ƶ���
�ķ�Ӧƽ�������ƶ���![]() �������ӣ�
�������ӣ�
�ڸ���ͼ�����pH=7ʱ������Ч����ã������ʺ������������ԣ�
��I-(aq)+AgCl(s)=Agl(s)+Cl-(aq)��ƽ�ⳣ��K= ![]() ����c(I-)=
����c(I-)= ![]() =
= ![]() =4.2��10-7 mol��L-1��
=4.2��10-7 mol��L-1��
(4) �ٸ��ݱ������ݷ�����0.032k=0.20m��0.80n��0.144k=0.60m��0.40n ��0.128k=0.80m��0.20n ����m=2��n=1����ѡC��
�ڸ���mn�Ĵ�С������������Ũ�ȶԷ�Ӧ���ʵ�Ӱ�����������Ũ��Ӱ�졣

 ����ʦ���һ��һ��ϵ�д�
����ʦ���һ��һ��ϵ�д�