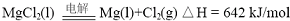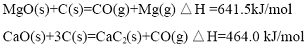题目内容
MgO、Rb2O、CaO、BaO四种离子晶体熔点的高低顺序是( )A.MgO>Rb2O>BaO>CaO
B.MgO>CaO>BaO>Rb2O
C.CaO>BaO>MgO>Rb2O
D.CaO>BaO>Rb2O>MgO
解析:四种离子晶体所含阴离子相同,所含阳离子不同。Mg2+、Rb+、Ca2+、Ba2+比较,Rb+所带电荷最少且半径最大,其与O2-形成的离子键最弱,使Rb2O的熔点最低。Mg2+、Ca2+、Ba2+比较,它们所带正电荷一样多,半径Mg2+<Ca2+<Ba2+,与O2-形成的离子键由强到弱的顺序是Mg2+>Ca2+>Ba2+,相应离子晶体的熔点由高到低的顺序是MgO>CaO>BaO。综上所述,四种离子晶体熔点的高低顺序是MgO>CaO>BaO>Rb2O,选B项。
答案:B

练习册系列答案
 举一反三单元同步过关卷系列答案
举一反三单元同步过关卷系列答案
相关题目
 (2013?深圳一模)水钴矿中除SiO2外,还有9.24% CoO、2.78% Fe2O3、0.96% MgO、0.084% CaO.从中提取钴的主要工艺流程如下:
(2013?深圳一模)水钴矿中除SiO2外,还有9.24% CoO、2.78% Fe2O3、0.96% MgO、0.084% CaO.从中提取钴的主要工艺流程如下:

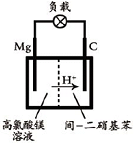 (2012?江苏一模)镁及其合金广泛应用于航空航天、交通、电池等行业,金属镁的制备方法主要有:
(2012?江苏一模)镁及其合金广泛应用于航空航天、交通、电池等行业,金属镁的制备方法主要有: