题目内容
向100 mL 0.1 mol·L-1硫酸铝铵[NH4Al(SO4)2]溶液中逐滴滴入0.1 mol·L-1 Ba(OH)2溶液。随着Ba(OH)2溶液体积V的变化,沉淀总物质的量n的变化如图所示。则下列说法中正确的是( )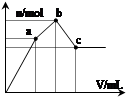
| A.a点的溶液呈中性 |
| B.b点到c点之间发生反应的离子方程式是:Al3++2SO42-+2Ba2++3OH— =Al(OH)3↓+2BaSO4↓ |
| C.c点加入Ba(OH)2溶液的体积为200 mL |
| D.c点溶液呈碱性 |
D
解析试题分析:A、a点发生的反应为2Al3++3Ba2++3(SO4)2-+6OH-=2Al(OH)3↓+3BaSO4↓此时溶液中的溶质为(NH4)2SO4溶液为酸性,错误;B、发生的反应为Al(OH)3+OH-=AlO2-+2H2O,错误;C、发生的反应为NH4++Al3++2SO42-+Ba2++5OH-=2BaSO4↓+AlO2-+NH3·H2O+2H2O加入的体积应为250mL,错误;D、发生的反应为NH4++Al3++2SO42-+Ba2++5OH-=2BaSO4↓+AlO2-+NH3·H2O+2H2O,溶液显碱性,正确。
考点:考查离子方程式、物质的性质等相关知识。

下列判断正确的是 ( )
①Ca(OH)2微溶于水,所以Ca(OH)2是弱电解质;②强电解质溶液的导电能力可能比弱电解质导电能力弱;③液态氯化氢不导电,但它是电解质;④碳酸氢钠是弱酸的酸式盐,所以是弱电解质;⑤SO3溶于水后导电,所以SO3是电解质;⑥Cu能导电,但它不是化合物,所以Cu是非电解质
| A.②③ | B.②③⑥ | C.①④⑤⑥ | D.②③⑤ |
能正确表示下列反应的离子方程式的是( )
| A.硫酸铝溶液中加入过量氨水 Al3++3OH-=Al(OH)3↓ |
| B.碳酸钠溶液中加入澄清石灰水 Ca(OH)2+ CO32-=CaCO3↓+2OH- |
| C.冷的氢氧化钠溶液中通入氯气 Cl2+2OH-=ClO-+Cl-+H2O |
| D.稀硫酸中加入铁粉 2Fe+6H+=2Fe3++3H2↑ |
下列离子反应方程式正确的是 ( )
| A.硫酸亚铁溶液中加入用硫酸酸化的过氧化氢溶液:2Fe2++2H++H2O2 = 2Fe3++2H2O |
B.电解饱和食盐水:2Cl- +2H+ H2↑+C12↑ H2↑+C12↑ |
| C.向氯化铝溶液中加入过量氨水:Al3++ 4NH3·H2O=[Al(OH)4]-+ 4NH4+ |
D.铜粉与98.3%的硫酸加热下反应:Cu + 4H+ + SO42― Cu2++ SO2↑+ 2H2O Cu2++ SO2↑+ 2H2O |
某物质的水溶液能导电,且该物质属于非电解质,溶于水时化学键被破坏的是
| A.液溴 | B.蔗糖 | C.干冰 | D.硫酸钡 |
离子方程式BaCO3 + 2H+ = CO2↑ + H2O + Ba2+ 中的H+不能代表的物质是( )
①HCl;②H2SO4;③HNO3;④NaHSO4;⑤CH3COOH
| A.①③ | B.①④⑤ | C.②④⑤ | D.①⑤ |
下列物质中都含有氢元素,按照已学知识判断其中属于酸的是
| A.NH3 | B.CH4 | C.NaHCO3 | D.HClO3 |
下物质分类组合正确的是 ( )
| | A | B | C | D |
| 强电解质 | HBr | FeCl3 | H3PO4 | Ca(OH)2 |
| 弱电解质 | HF | CH3COOH | BaSO4 | HI |
| 非电解质 | NH3 | Cu | H2O | C2H5OH |
下列关于强、弱电解质的叙述,有错误的是
| A.强电解质在溶液中完全电离,不存在电离平衡 |
| B.在溶液中,导电能力强的电解质是强电解质,导电能力弱的电解质是弱电解质 |
| C.强电解质都是离子化合物,弱电解质都是共价化合物 |
| D.纯净的强电解质在液态时,有的导电,有的不导电 |