题目内容
使用单质铜制取硝酸铜,最适宜的方法是: B
| A.Cu+稀HNO3 | B.Cu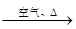 CuO CuO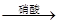 Cu(NO3)2 Cu(NO3)2 |
| C.Cu+浓HNO3 | D.Cu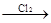 CuCl2 CuCl2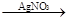 Cu(NO3)2 Cu(NO3)2 |
B
最适宜的方法是B ,因为不产生有毒的气体,对环境无污染。其他方法都有污染环境的地方。

练习册系列答案
 一本好题口算题卡系列答案
一本好题口算题卡系列答案
相关题目
题目内容
| A.Cu+稀HNO3 | B.Cu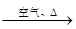 CuO CuO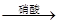 Cu(NO3)2 Cu(NO3)2 |
| C.Cu+浓HNO3 | D.Cu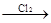 CuCl2 CuCl2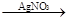 Cu(NO3)2 Cu(NO3)2 |

 一本好题口算题卡系列答案
一本好题口算题卡系列答案