题目内容
某元素的激发态原子的电子排布式为1s22s22p63s23p34s1,则该元素基态原子的电子排布式为 ;元素符号为 ;其最高价氧化物对应的水化物的化学式是 .
分析:根据激发态原子核外电子排布式确定该原子核外电子数,原子中核外电子数=原子序数,从而确定该元素,根据构造原理写出该元素基态原子核外电子排布式,在主族元素中,元素的最高化合价等于其族序数,从而确定其最高价氧化物对应的水化物.
解答:解:根据激发态原子核外电子排布式知该元素核外有16个电子,根据构造原理知,其基态原子核外电子排布式为:1s22s22p63s23p4,原子序数=原子核外电子数,所以该元素是S元素,S元素最外层有6个电子,其最高化合价是+6价,其最高价氧化物对应的水化物是硫酸,其化学式为H2SO4,
故答案为:1s22s22p63s23p4;S;H2SO4.
故答案为:1s22s22p63s23p4;S;H2SO4.
点评:本题考查了原子核外电子排布式的书写、元素的确定、其最高价含氧酸的确定等知识点,正确推断元素是解本题关键,难度不大.

练习册系列答案
相关题目

 2s
2s 3s
3s 4s
4s ,则该元素基态原子的电子排布式为 ;其最高价氧化物对应的水化物的化学式是
,则该元素基态原子的电子排布式为 ;其最高价氧化物对应的水化物的化学式是 
 2s
2s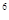 3s
3s 4s
4s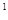 ,则该元素基态原子的电子排布式为
;其最高价氧化物对应的水化物的化学式是
,则该元素基态原子的电子排布式为
;其最高价氧化物对应的水化物的化学式是
 2s
2s 3s
3s 4s
4s ,则该元素基态原子的电子排布式为 ;元素符号为 ;其最高价氧化物对应的水化物的酸性比碳酸 (填
,则该元素基态原子的电子排布式为 ;元素符号为 ;其最高价氧化物对应的水化物的酸性比碳酸 (填 “强”或“弱”)。
“强”或“弱”)。