题目内容
已知A(g)+B(g)?C(g)+D(g)反应的平衡常数和温度的关系如下:
回答下列问题:
(1)该反应的平衡常数表达式K=
,△H
(2)判断该反应是否达到平衡的依据为
a.压强不随时间改变 b.气体的密度不随时间改变
c.c(A)不随时间改变 d.单位时间里生成C和A的物质的量相等
(3)1200℃时反应C(g)+D(g)?A(g)+B(g)的平衡常数的值为
(4)某温度下?平衡浓度符合下式?
c(A)?c(B)?═c(C)?c(D)?试判断此时的温度为
| 温度/℃ | 700 | 800 | 830 | 1000 | 1200 | |
| 平衡常数K | 1.7 | 1.1 | 1.0 | 0.6 | 0.4 |
(1)该反应的平衡常数表达式K=
| c(C)?c(D) |
| c(A)?c(B) |
| c(C)?c(D) |
| c(A)?c(B) |
<
<
0(填“<”“>”“=”);(2)判断该反应是否达到平衡的依据为
cd
cd
(填正确选项前的字母):a.压强不随时间改变 b.气体的密度不随时间改变
c.c(A)不随时间改变 d.单位时间里生成C和A的物质的量相等
(3)1200℃时反应C(g)+D(g)?A(g)+B(g)的平衡常数的值为
2.5
2.5
.(4)某温度下?平衡浓度符合下式?
c(A)?c(B)?═c(C)?c(D)?试判断此时的温度为
830
830
℃分析:(1)化学平衡常数,是指在一定温度下,可逆反应达到平衡时各生成物浓度的化学计量数次幂的乘积除以各反应物浓度的化学计量数次幂的乘积所得的比值,据此书写,
由表中数据可知,温度升高平衡常数降低,平衡向逆反应移动,故正反应为放热反应;
(2)根据化学平衡状态的特征解答,当反应达到平衡状态时,正逆反应速率相等,各物质的浓度、百分含量不变,以及由此衍生的一些量也不发生变化,解题时要注意,选择判断的物理量,随着反应的进行发生变化,当该物理量由变化到定值时,说明可逆反应到达平衡状态;
(3)同一温度下,同一反应的正、逆反应的平衡常数互为倒数,据此计算;
(4)某温度下,平衡浓度符合c(A)?c(B)═c(C)?c(D),则
=1,即平衡常数为1,据此判断.
由表中数据可知,温度升高平衡常数降低,平衡向逆反应移动,故正反应为放热反应;
(2)根据化学平衡状态的特征解答,当反应达到平衡状态时,正逆反应速率相等,各物质的浓度、百分含量不变,以及由此衍生的一些量也不发生变化,解题时要注意,选择判断的物理量,随着反应的进行发生变化,当该物理量由变化到定值时,说明可逆反应到达平衡状态;
(3)同一温度下,同一反应的正、逆反应的平衡常数互为倒数,据此计算;
(4)某温度下,平衡浓度符合c(A)?c(B)═c(C)?c(D),则
| c(C)?c(D) |
| c(A)?c(B) |
解答:解:(1)可逆反应A(g)+B(g)?C(g)+D(g)的平衡常数k=
,由表中数据可知,温度升高平衡常数降低,平衡向逆反应移动,故正反应为放热反应,即△H<0,
故答案为:
,<;
(2)a.该反应前后气体的物质的量不变,压强始终不变,故压强不随时间改变不能说明到达平衡,故a错误;
b.该反应前后气体的体积不变,混合气体的质量不变,气体的密度始终不变,故b错误;
c.可逆反应到达平衡时,各物质的浓度不变,故c(A)不随时间改变,说明到达平衡,故c正确;
d.单位时间里生成C和A的物质的量相等,说明单位时间内生成的物质的量与消耗C的物质的量相等,说明到达平衡,故d正确;
故选cd;
(3)同一温度下,同一反应的正、逆反应的平衡常数互为倒数,故1200℃时反应C(g)+D(g)?A(g)+B(g)的平衡常数的值为
=2.5,
故答案为:2.5;
(4)某温度下,平衡浓度符合c(A)?c(B)═c(C)?c(D),则
=1,即平衡常数为1,故此时的温度为830℃,
故答案为:830.
| c(C)?c(D) |
| c(A)?c(B) |
故答案为:
| c(C)?c(D) |
| c(A)?c(B) |
(2)a.该反应前后气体的物质的量不变,压强始终不变,故压强不随时间改变不能说明到达平衡,故a错误;
b.该反应前后气体的体积不变,混合气体的质量不变,气体的密度始终不变,故b错误;
c.可逆反应到达平衡时,各物质的浓度不变,故c(A)不随时间改变,说明到达平衡,故c正确;
d.单位时间里生成C和A的物质的量相等,说明单位时间内生成的物质的量与消耗C的物质的量相等,说明到达平衡,故d正确;
故选cd;
(3)同一温度下,同一反应的正、逆反应的平衡常数互为倒数,故1200℃时反应C(g)+D(g)?A(g)+B(g)的平衡常数的值为
| 1 |
| 0.4 |
故答案为:2.5;
(4)某温度下,平衡浓度符合c(A)?c(B)═c(C)?c(D),则
| c(C)?c(D) |
| c(A)?c(B) |
故答案为:830.
点评:考查化学平衡常数、化学平衡的影响因素等,难度不大,注意化学平衡状态判断,选择判断的物理量,随着反应的进行发生变化,当该物理量由变化到定值时,说明可逆反应到达平衡状态.

练习册系列答案
 快乐暑假暑假能力自测中西书局系列答案
快乐暑假暑假能力自测中西书局系列答案
相关题目
已知A(g)+B(g)?C(g)+D(g)反应的平衡常数和温度的关系如下:
830℃时,向一个2L的密闭容器中充入0.2mol的A和0.8mol的B,反应初始4s内A的平均反应速率v(A)=0.005mol/(L?s).下列说法正确的是( )
| 温度/℃ | 700 | 800 | 830 | 1000 | 1200 |
| 平衡常数 | 1.7 | 1.1 | 1.0 | 0.6 | 0.4 |
| A、4s时c(B)为0.76mol/L |
| B、830℃达平衡时,A的转化率为80% |
| C、反应达平衡后,升高温度,平衡正向移动 |
| D、1200℃时反应C(g)+D(g)?A(g)+B(g)的平衡常数的值为0.4 |
科学家一直致力于研究常温、常压下“人工固氮”的新方法.曾有实验报道:在常温、常压、光照条件下,N2在催化剂(掺有少量Fe2O3的TiO2)表面与水发生反应,生成的主要产物为NH3.进一步研究NH3生成量与温度的关系,部分实验数据见下表(光照、N2压力1.0×105 Pa、反应时间3h):
相应的化学方程式:N2(g)+3H2O(l)?2NH3(g)+
O2(g)△H=+765.2kJ?mol-1
回答下列问题:
(1)该反应在较低温度下能否自发进行? ;
(2)从323K到353K,氨气的生成量减少的原因 ;
(3)请画出上述反应在有催化剂与无催化剂两种情况下反应过程中体系能量变化示意图1,并进行必要标注;
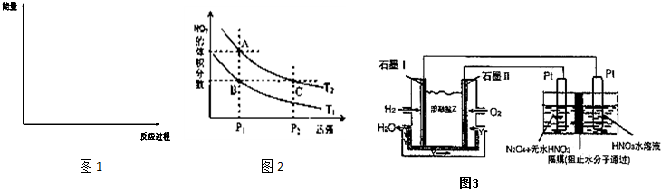
(4)工业合成氨的反应为N2(g)+3H2(g)?2NH3(g).设在容积为2.0L的密闭容器中充入0.60mol N2(g)和1.60mol H2(g),反应在一定条件下达到平衡时,NH3的物质的量分数(NH3的物质的量与反应体系中总的物质的量之比)为
.该条件下反应2NH3(g)?N2(g)+3H2(g)的平衡常数为 ;
(5)利用N2和H2可以实验NH3的工业合成,而氨又可以进一步制备硝酸,在工业上一般可进行连续生产.请回答下列问题:
已知:N2(g)+O2(g)═2NO(g)△H=+180.5kJ?mol-1
N2(g)+3H2(g)═2NH3(g)△H=-92.4kJ?mol-1
2H2(g)+O2(g)═2H2O(g)△H=-483.6kJ?mol-1
则氨气经催化氧化生成一氧化氮气体和水蒸气的热化学方程式为 ;
(6)对反应N2O4(g)?2NO2(g),在温度分别为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图2所示.下列说法正确的是 ;
A.A、C两点的反应速率:A>C
B.B、C两点的气体的平均相对分子质量:B<C
C.A、C两点气体的颜色:A深,C浅
D.由状态B到状态A,可以用加热的方法
(7)现以H2、O2、熔融盐Na2CO3组成的燃料电池,采用电解法制备N2O5,装置如图3所示,其中Y为CO2.写出石墨I电极上发生反应的电极反应式 ;在电解池中生成1molN2O5转移电子的物质的量为 .
| T/K | 303 | 313 | 323 | 353 |
| NH3生成量/(10-6 mol) | 4.8 | 5.9 | 6.0 | 2.0 |
| 3 |
| 2 |
回答下列问题:
(1)该反应在较低温度下能否自发进行?
(2)从323K到353K,氨气的生成量减少的原因
(3)请画出上述反应在有催化剂与无催化剂两种情况下反应过程中体系能量变化示意图1,并进行必要标注;

(4)工业合成氨的反应为N2(g)+3H2(g)?2NH3(g).设在容积为2.0L的密闭容器中充入0.60mol N2(g)和1.60mol H2(g),反应在一定条件下达到平衡时,NH3的物质的量分数(NH3的物质的量与反应体系中总的物质的量之比)为
| 4 |
| 7 |
(5)利用N2和H2可以实验NH3的工业合成,而氨又可以进一步制备硝酸,在工业上一般可进行连续生产.请回答下列问题:
已知:N2(g)+O2(g)═2NO(g)△H=+180.5kJ?mol-1
N2(g)+3H2(g)═2NH3(g)△H=-92.4kJ?mol-1
2H2(g)+O2(g)═2H2O(g)△H=-483.6kJ?mol-1
则氨气经催化氧化生成一氧化氮气体和水蒸气的热化学方程式为
(6)对反应N2O4(g)?2NO2(g),在温度分别为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图2所示.下列说法正确的是
A.A、C两点的反应速率:A>C
B.B、C两点的气体的平均相对分子质量:B<C
C.A、C两点气体的颜色:A深,C浅
D.由状态B到状态A,可以用加热的方法
(7)现以H2、O2、熔融盐Na2CO3组成的燃料电池,采用电解法制备N2O5,装置如图3所示,其中Y为CO2.写出石墨I电极上发生反应的电极反应式
已知A(g)+B(g)?C(g)+D(g)反应的平衡常数和温度的关系如下:
回答下列问题:
(1)该反应的平衡常数表达式K= ,△H 0(填“<”“>”“=”);
(2)830℃时,向一个5L的密闭容器中充入0.20mol的A和0.80mol的B,如反应初始6s内A的平均反应速率v(A)=0.003mol?L-1?s-1.,则6s时c(A)= mol?L-1,C的物质的量为 mol;若反应经一段时间后,达到平衡时A的转化率为 ,如果这时向该密闭容器中再充入1mol氩气,平衡时A的转化率为 ;
(3)判断该反应是否达到平衡的依据为 (填正确选项前的字母):
a.压强不随时间改变 b.气体的密度不随时间改变
c.c(A)不随时问改变 d.单位时间里生成c和D的物质的量相等
(4)1200℃时反应C(g)+D(g)?A(g)+B(g)的平衡常数的值为 .
| |温度/℃ | 700 | 900 | 830 | 1000 | 1200 |
| 平衡常数 | 1.7 | 1.1 | 1.0 | 0.6 | 0.4 |
(1)该反应的平衡常数表达式K= ,△H 0(填“<”“>”“=”);
(2)830℃时,向一个5L的密闭容器中充入0.20mol的A和0.80mol的B,如反应初始6s内A的平均反应速率v(A)=0.003mol?L-1?s-1.,则6s时c(A)= mol?L-1,C的物质的量为 mol;若反应经一段时间后,达到平衡时A的转化率为 ,如果这时向该密闭容器中再充入1mol氩气,平衡时A的转化率为 ;
(3)判断该反应是否达到平衡的依据为 (填正确选项前的字母):
a.压强不随时间改变 b.气体的密度不随时间改变
c.c(A)不随时问改变 d.单位时间里生成c和D的物质的量相等
(4)1200℃时反应C(g)+D(g)?A(g)+B(g)的平衡常数的值为 .

 已知A(g)+B(g)?C(g)+D(g) 反应过程中的能量变化如图所示,回答下列问题.
已知A(g)+B(g)?C(g)+D(g) 反应过程中的能量变化如图所示,回答下列问题.