题目内容
有一包固体粉末,由CaCO3、Na2SO4、KNO3、BaCl2、CuSO4中的三种物质组成,取样品进行如下实验,从实验可以判断:
| A.该固体粉末中一定不含有BaCl2 |
| B.该固体粉末中一定含有KNO3 |
| C.它的组成可能是CaCO3、BaCl2、CuSO4 |
| D.它的组成一定是CaCO3、Na2SO4、KNO3 |
B
解析试题分析:最终得到的都是无色溶液一定不含有硫酸铜,白色沉淀完全溶与盐酸说明不含硫酸根离子,即无硫酸钠,可能含有氯化钡,所以答案选B。
考点:考查离子的反应。

练习册系列答案
 教材全解字词句篇系列答案
教材全解字词句篇系列答案
相关题目
在电解质溶液的导电性装置(如图所示)中,若向某一电解质溶液中逐滴加入另一溶液时,出现灯泡由亮变暗,至熄灭后又逐渐变亮现象的是
| A.氢氧化钡溶液中逐滴加入硫酸 |
| B.氢氧化钠溶液中逐滴加入硫酸 |
| C.石灰乳中逐滴加入稀盐酸 |
| D.食盐溶液中逐滴加入盐酸 |
如图表示在某溶液中滴加Ba(OH)2溶液时,生成的沉淀的物质的量随Ba(OH)2溶液的体积变化关系。该溶液的成分可能是
| A.NH4Al(SO4)2 | B.KAl(SO4)2 |
| C.Al2(SO4)3 | D.Na2SO4与NaAlO2组成的混合物 |
关于强弱电解质及非电解质的组合完全正确的是
| | A | B | C | D |
| 强电解质 | NaCl | H2SO4 | CaCO3 | HNO3 |
| 弱电解质 | HF | BaSO4 | HClO | CH3COOH |
| 非电解质 | Cl2 | CS2 | 盐酸 | SO2 |
下列离子方程式,正确的是
| A.氢氧化铁与盐酸反应:H++OH-=H2O |
| B.CaCO3溶于稀盐酸中:CO32-+2H+=CO2↑+H2O |
| C.铁与H2SO4反应:Fe+2H+=Fe3++H2↑ |
D.Ca(HCO3)2溶液与少量NaOH溶液反应:HCO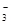 +Ca2++OH-= CaCO3↓+H2O +Ca2++OH-= CaCO3↓+H2O |
下表中评价合理的是
| 选项 | 化学反应及其离子方程式 | 评价 |
| A | 铁与稀盐酸反应: 2Fe+6H+=2Fe3++3H2↑ | 正确 |
| B | 大理石溶于醋酸的反应: CaCO3+ 2H+=Ca2++CO2↑+H2O | 错误,醋酸应写为分子形式CH3COOH,CaCO3应写成离子形式 |
| C | 向Ba(OH)2溶液中滴加少量NaHSO4溶液:Ba2+ + OH- + H+ + SO42- = BaSO4↓+ H2O | 错误, |
| D | NH4HCO3溶液与过量KOH浓溶液共热:NH4++ OH- NH3↑+ H2O NH3↑+ H2O | 错误,HCO3-也可以与OH-反应 |
向100ml的下列各溶液中加入少量的NaOH固体,溶液导电性变化最不明显的是
| A.盐酸 | B.醋酸 | C.蒸馏水 | D.氨水 |
在某无色酸性溶液中能大量共存的一组离子是
| A.NH4+、SO42-、Al3+、NO3- | B.Na+、K+、HCO3-、NO3- |
| C.Na+、Ca2+、NO3- 、CO32- | D.K+、Cu2+、NH4+、NO3- |
在电解质溶液的导电性装置(如图所示)中,若向某一电解质溶液中逐滴加入另一溶液时,则灯泡由亮变暗,至熄灭后又逐渐变亮的是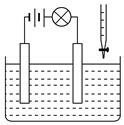
| A.盐酸中逐滴加入食盐溶液 |
| B.硫酸中逐滴加入氢氧化钠溶液 |
| C.石灰乳中逐滴加入稀盐酸 |
| D.硫酸中逐滴加入氢氧化钡溶液 |