题目内容
CuI可用于监测空气中是否含有汞蒸气:4CuI(白色)+Hg=Cu2HgI4(亮黄色)+2Cu.下列关于该化学方程式的说法正确的是( )
| A、该反应被氧化的元素是铜元素和汞元素 |
| B、该反应的氧化剂为CuI |
| C、Cu2HgI4既是氧化产物又是还原产物 |
| D、反应中每生成2mol Cu转移电子2mol |
考点:氧化还原反应
专题:氧化还原反应专题
分析:4CuI+Hg=Cu2HgI4+2Cu中,Cu元素的化合价由+1价降低为0,Hg元素的化合价由0升高为+2价,以此来解答.
解答:
解:A.氧化还原反应中,被氧化的元素是化合价升高的汞元素,铜元素是被还原,故A错误;
B.Cu元素的化合价降低,则CuI为氧化剂,故B正确;
C.Hg元素的化合价升高,则Cu2HgI4为氧化产物,故C错误;
D.氧化还原反应中,化合价升高值=化合价降低值=转移电子数,做氧化剂的CuI~Cu~e-,反应中每生成2mol Cu转移电子2mol,故D正确.
故选BD.
B.Cu元素的化合价降低,则CuI为氧化剂,故B正确;
C.Hg元素的化合价升高,则Cu2HgI4为氧化产物,故C错误;
D.氧化还原反应中,化合价升高值=化合价降低值=转移电子数,做氧化剂的CuI~Cu~e-,反应中每生成2mol Cu转移电子2mol,故D正确.
故选BD.
点评:本题考查氧化还原反应,为高频考点,把握反应中元素的化合价为解答的关键,侧重氧化还原反应基本概念及转移电子的考查,注意CuI部分为氧化剂,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
下列关于“化学与健康”的说法不正确的是( )
| A、“血液透析”利用了胶体的性质 |
| B、服用铬含量超标的药用胶囊会对人对健康造成危害 |
| C、光化学烟雾不会引起呼吸道疾病 |
| D、食用一定量的油脂能促进人体对某些维生素的吸收 |
与0.2mol H2O含有相同氢原子数的是( )
| A、0.2molHNO3 |
| B、标况下2.24L CH4 |
| C、1.7g NH3 |
| D、1.505×1022个HCl分子 |
下列实验方案中可行的事( )
| A、用溶解、过滤的方法分离CaCl2和NaCl的固体混合物 |
| B、用澄清石灰水检验CO中是否含有CO2 |
| C、用酒精把碘水中的碘萃取出来 |
| D、用BaCl2除去NaOH溶液中混有的少量Na2SO4 |
 下图表示的一些物质或概念间的从属关系中正确的是( )
下图表示的一些物质或概念间的从属关系中正确的是( )| X | Y | Z | |
| A | 氧化钙 | 氧化物 | 碱性氧化物 |
| B | 盐 | 化合物 | 电解质 |
| C | 胶体 | 分散系 | 混合体系 |
| D | 置换反应 | 氧化还原反应 | 离子反应 |
| A、A | B、B | C、C | D、D |
反应3A(g)+B(g)?2C(g)+2D(g),在不同情况下测得反应速率如下,其中反应速率最快的是( )
| A、v(B)=0.4mol?L-1?s-1 |
| B、v(C)=0.5mol?L-1?s-1 |
| C、v(D)=0.6mol?L-1?s-1 |
| D、v(A)=1.5mol?L-1?s-1 |
下列反应属于取代反应的是( )
| A、乙炔→乙烯 |
| B、乙醛→乙酸 |
| C、乙醛→乙醇 |
| D、乙醇→溴乙烷 |
已知25℃时Ksp[Al(OH)3]=1.0×10-33,Ksp[Fe(OH)3]=4.0×10-38.向Fe(NO3)3和Al(NO3)3的混合溶液中逐滴加入NaOH溶液,生成沉淀的物质的量与加入NaOH溶液的体积的关系如下图所示.计算表明当Fe3+完全沉淀时,Al3+恰好开始沉淀.下列说法正确的是( )
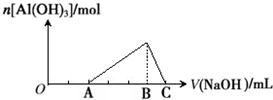

| A、原混合溶液中c(Fe3+):c(Al3+)=1:1 |
| B、Fe(NO3)3溶液中混有杂质Al(NO3)3可以加入过量的NaOH溶液除去 |
| C、B点两种沉淀共存,此时上层溶液中c(Al3+):c(Fe3+)=2.5×104 |
| D、C点溶液中的溶质只有NaAlO2 |
在某无色透明溶液中能大量共存的离子组是( )
| A、Cu2+、Na+、NO3-、Cl- |
| B、NH4+、Mg2+、NO3-、CO32- |
| C、Ag+、Na+、CO3-、Cl- |
| D、Na+、K+、NO3-、SO42- |