题目内容
【题目】氰化钠(NaCN)是一种基本化工原料,同时也是一种剧毒物质。一旦泄漏需要及时处理,一般可以通过喷洒双氧水或过硫酸钠(Na2S2O8)溶液来处理,以减轻环境污染。
I.(1)NaCN用双氧水处理后,产生一种酸式盐和一种能使湿润的红色石蕊试纸变蓝的气体,该反应的化学方程式是______。
Ⅱ.工业制备过硫酸钠的反应原理如下:
主反应:(NH4)2S2O8+2NaOH![]() Na2S2O8+2NH3↑+2H2O
Na2S2O8+2NH3↑+2H2O
副反应:2NH3+3Na2S2O8+6NaOH![]() 6Na2SO4+6H2O+N2
6Na2SO4+6H2O+N2
某化学小组利用上述原理在实验室制备过硫酸钠,并用过硫酸钠溶液处理含氰化钠的废水。
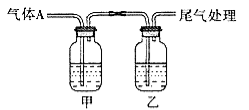
实验一:实验室通过如下图所示装置制备Na2S2O8。

(2)装置中盛放双氧水的仪器名称是______。
(3)装置a中反应产生的气体需要持续通入装置c的原因是______。
(4)上述装置中还需补充的实验仪器或装置有______(填字母)。
A.温度计 B.洗气瓶 C.水浴加热装置 D.环形玻璃搅拌棒
实验二:测定用过硫酸钠溶液处理后的废水中氰化钠的含量。
已知:①废水中氰化钠的最高排放标准为0.50mg/L。
②Ag++2CN-=[Ag(CN)2]-,Ag++I-=AgI↓,AgI呈黄色,且CN-优先与Ag+反应。实验如下:取1L处理后的NaCN废水,浓缩为10.00mL置于锥形瓶中,并滴加几滴KI溶液作指示剂,用1.0×10-3mol/L 的标准AgNO3溶液滴定,消耗AgNO3溶液的体积为5.00mL。
(5)滴定终点的现象是______。
(6)处理后的废水是否达到排放标准?______(填“是”或“否”)。
Ⅲ.(7)常温下,含硫微粒主要存在形式,受pH影响。利用电化学原理,用惰性电极电解饱和NaHSO4溶液也可以制备过硫酸钠。已知在阳极放电的离子主要为HSO4-,则阳极反应方程式为______。
【答案】NaCN+H2O2+H2O=NH3↑+NaHCO3 分液漏斗 将产生的氨气及时排除,防止发生副反应 AC 滴入最后一滴标准硝酸银溶液,锥形瓶中溶液恰好产生黄色沉淀,且半分钟沉淀不消失 是 2HSO4--2e-=S2O82-+2H+
【解析】
(1)根据元素分析,生成的酸式盐为碳酸氢钠,使湿润的红色石蕊试纸变蓝的气体为氨气,据此书写方程式;
(2)根据仪器特点可得仪器名称;
(3)根据已知主反应产生氨气,副反应氨气为反应物,从抑制副反应发生的角度分析;
(4)根据已知可知该反应要在一定温度下进行可得;
(5)废水溶液中KI为指示剂,用标准AgNO3溶液滴定,Ag+将CN-反应完全后与I-结合为AgI黄色沉淀,为终点,可得;
(6)根据Ag+~2NaCN消耗1.0×10-3mol/L的标准AgNO3溶液滴定,消耗AgNO3溶液的体积为5.00mL,则m(NaCN)=n(NaCN)×M(NaCN)=2n(AgNO3)×M(NaCN),再计算其浓度,与0.50mg/L比较可得;
(7)阳极由HSO4-失电子被氧化为S2O82-,据此分析。
(1)NaCN用双氧水处理后,生成的酸式盐为碳酸氢钠,使湿润的红色石蕊试纸变蓝的气体为氨气,反应方程式为NaCN+H2O2+H2O=NH3↑+NaHCO3;
(2)装置中盛放双氧水的仪器为分液漏斗;
(3)主反应产生氨气,副反应氨气为反应物,故置a中反应产生的气体需要持续通入装置c,为了将产生的氨气及时排除,防止发生副反应;
(4)由题可知,主反应的温度为55℃,因此装置中还需要温度计,为维持温度,采用水浴加热,需要水浴加热装置,所以合理选项是AC;
(5)废水溶液中KI为指示剂,用标准AgNO3溶液滴定,Ag+将CN-反应完全后与I-结合为AgI黄色沉淀,因此终点现象为:滴入最后一滴标准硝酸银溶液,锥形瓶中溶液恰好产生黄色沉淀,且半分钟沉淀不消失;
(6) 根据Ag+~2NaCN消耗1.0×10-3mol/L的标准AgNO3溶液滴定,消耗AgNO3溶液的体积为5.00mL,则m(NaCN)=n(NaCN)×M(NaCN)=2n(AgNO3)×M(NaCN)=2×1.0×10-3mol/L×5.00×10 -3L×49g/mol=49×10 -5g,废水中氰化钠的浓度为c(NaCN)=![]() =0.49mg/L<0.5mg/L,故达到排放标准;
=0.49mg/L<0.5mg/L,故达到排放标准;
(7)阳极发生氧化反应,由HSO4-失电子被氧化为S2O82-,电极反应式为:2HSO4--2e-=S2O82-+2H+。