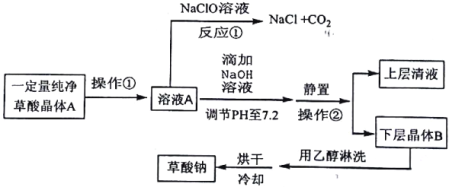
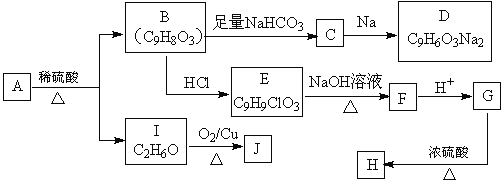
题目内容
【题目】钛的化合物如TiSe2、Ti(NO3)4、TiCl4、酒石酸钛等均有着广泛用途。

(1)写出Se的基态原子的外围电子排布式 。
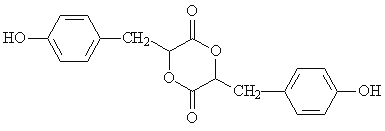
(2)酒石酸钛配合物广泛应用于药物合成。酒石酸(结构如下图所示)中羧基氧原子的轨道杂化类型分别是 ,1 mol酒石酸中π键的数目是 。
(3)TiCl4熔点是—25℃,沸点136.4℃,可溶于苯或CCl4,该晶体属于 晶体;
NO3-离子的空间构型为 。
(4)主族元素A和钛同周期,具有相同的最外层电子数,元素B原子的p能级所含电子总数与s能级所含电子总数相等,且其形成的氢化物分子之间存在氢键。元素A、元素B和钛三者形成的晶体的晶胞如图所示,写出该晶体的化学式 (用元素符号表示)。
【答案】(1)4s24p4 (2)sp3和 sp2 2mol(3)平面三角形(4)CaTiO3
【解析】
试题分析:(1)Se的原子核外有34个电子,最外层有6个电子,则其核外电子分4层排布,最外层为电子排布为4s24p4;
(2)羧基的结构式为 ,两个O原子的价层电子对数分别为3、4,则杂化类型分别为sp2、sp3;酒石酸分子中含有2个羧基,每个羧基含有一个C=O,双键中含有一个π键,则一分子酒石酸中含有2个π键,则1mol酒石酸中π键的数目是2NA;
,两个O原子的价层电子对数分别为3、4,则杂化类型分别为sp2、sp3;酒石酸分子中含有2个羧基,每个羧基含有一个C=O,双键中含有一个π键,则一分子酒石酸中含有2个π键,则1mol酒石酸中π键的数目是2NA;
(3)由于TiCl4熔点是-25℃,沸点136.4℃,可溶于苯或CCl4,分子晶体的熔沸点较低,所以TiCl4属于分子晶体;NO3-中N原子的价层电子对数=3+1/2(5+1-3×2)=3,属于sp2杂化,没有孤电子对,所以NO3-的构型为平面三角形;
(4)主族元素A和钛同周期,具有相同的最外层电子数,则最外层含有2个电子,A为Ca元素,元素B原子的p能级所含电子总数与s能级所含电子总数相等,且其形成的氢化物分子之间存在氢键,已知N、O、F的氢化物能形成氢键,则B为O,Ca占据晶胞的顶点,则晶胞中Ca的个数为1/8×8=1,O占据面心,则晶胞中O原子的个数为1/2×6=3,Ti在晶胞内部,完全属于该晶胞,则该晶体的化学式CaTiO3。