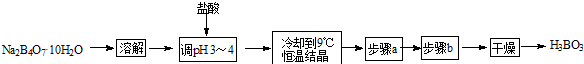
题目内容
13.下列关于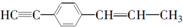 的说法中正确的是( )
的说法中正确的是( )| A. | 有7个碳原子可能在同一直线上 | |
| B. | 只可能有5个碳原子在同一直线上 | |
| C. | 最多只可能有9个碳原子在同一平面上 | |
| D. | 所有原子都可能在同一平面上 |
分析 根据甲烷的正四面体结构、乙烯平面结构、乙炔直线型、苯的平面结构分析,其它有机物的共线、共面可在此基础上进行判断.注意碳碳单键可以旋转.
解答 解:有机物的结构为 可以看出,最多只有5个碳原子在同一条直线上,所有的碳原子(11个)都可能在同一平面上,而-CH3上有氢原子最多只有1个在此平面上,故选B.
可以看出,最多只有5个碳原子在同一条直线上,所有的碳原子(11个)都可能在同一平面上,而-CH3上有氢原子最多只有1个在此平面上,故选B.
点评 本题主要考查有机化合物的结构特点,难度中等,注意从甲烷、乙烯、苯和乙炔的结构特点判断有机分子的空间结构.

练习册系列答案
相关题目
3. 氨气是生产化肥、硝酸等的重要原料,围绕合成氨人们进行了一系列的研究
氨气是生产化肥、硝酸等的重要原料,围绕合成氨人们进行了一系列的研究
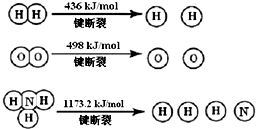
(1)氢气既能与氮气又能与氧气发生反应,但是反应的条件却不相同.已知:
2H2(g)+O2(g)=2H2O (g)△H=-483.6kJ/mol
3H2 (g)+N2(g) 2NH3(g)△H=-92.4kJ/mol
计算断裂1mol N≡N键需要能量946kJ,氮气分子中化学键比氧气分子中的化学键键强(填“强”或“弱”),因此氢气与二者反应的条件不同.
(2)固氮是科学家致力研究的重要课题.自然界中存在天然的大气固氮过程:N2(g)+O2(g)=2NO (g)△H=+180.8kJ/mol,工业合成氨则是人工固氮.分析两种固氮反应的平衡常数,下列结论正确的是BC.
A.常温下,大气固氮几乎不可能进行,而工业固氮非常容易进行
B.人类大规模模拟大气固氮是无意义的
C.工业固氮温度越低,氮气与氢气反应越完全
D.K越大说明合成氨反应的速率越大.
 氨气是生产化肥、硝酸等的重要原料,围绕合成氨人们进行了一系列的研究
氨气是生产化肥、硝酸等的重要原料,围绕合成氨人们进行了一系列的研究(1)氢气既能与氮气又能与氧气发生反应,但是反应的条件却不相同.已知:
2H2(g)+O2(g)=2H2O (g)△H=-483.6kJ/mol
3H2 (g)+N2(g) 2NH3(g)△H=-92.4kJ/mol
计算断裂1mol N≡N键需要能量946kJ,氮气分子中化学键比氧气分子中的化学键键强(填“强”或“弱”),因此氢气与二者反应的条件不同.
(2)固氮是科学家致力研究的重要课题.自然界中存在天然的大气固氮过程:N2(g)+O2(g)=2NO (g)△H=+180.8kJ/mol,工业合成氨则是人工固氮.分析两种固氮反应的平衡常数,下列结论正确的是BC.
| 反应 | 大气固氮 | 工业固氮 | ||||
| 温度/℃ | 27 | 2000 | 25 | 350 | 400 | 450 |
| K | 3.84×10-31 | 0.1 | 5×108 | 1.847 | 0.507 | 0.152 |
B.人类大规模模拟大气固氮是无意义的
C.工业固氮温度越低,氮气与氢气反应越完全
D.K越大说明合成氨反应的速率越大.
4.将铜粉放入稀硫酸中,加热无明显反应发生.但加入某物质后,发现铜粉质量逐渐减少,该物质不可能是( )
| A. | Fe2(SO4)3 | B. | ZnSO4 | C. | KNO3 | D. | O2 |
1.某化学兴趣小组为了探索铝电极在原电池中的作用,设计并进行了以下一系列实验,实验结果记录如下.试根据下表中的实验现象回答下列问题:
(1)实验1、4、5中负极分别是Mg、Al、Zn;
(2)写出实验3中的正极反应式2H++2e-═H2↑.
| 编号 | 电极材料 | 电解质溶液 | 电流计指针偏转方向 |
| 1 | Al、Mg | 稀盐酸 | 偏向Al |
| 2 | Al、Cu | 稀盐酸 | 偏向Cu |
| 3 | Al、石墨 | 稀盐酸 | 偏向石墨 |
| 4 | Al、Mg | 氢氧化钠 | 偏向Mg |
| 5 | Al、Zn | 稀盐酸 | 偏向Al |
(2)写出实验3中的正极反应式2H++2e-═H2↑.
5.下列各组溶液中,不用任何试剂无法鉴别的是( )
| A. | NaCl、Na2CO3、NaI、AgNO3 | B. | HCl、Na2CO3、新制氯水、NaI | ||
| C. | Na2S、HCl、FeCl3、NaCl | D. | AlCl3、BaCl2、Na2CO3、H2SO4 |
2.下列卤代烃,在一定条件下,能发生消去反应且产物只有一种的是( )
| A. | CH3Cl | B. | CH3-CHBr-CH3 | C. | 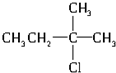 | D. | 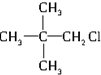 |
3.(1)要除去如表所列物质中的杂质(括号内为杂质),从(I)中选择适宜的试剂,从(II)中选择分离提纯的方法,用序号填入表中.
(Ⅰ)试剂:a.浓硫酸 b.氢氧化钠 c.生石灰 d.水 e.浓溴水
(Ⅱ)方法:A.洗气 B.分液 C.蒸馏
(2)以上采用的操作中,B使用的主要玻璃仪器是分液漏斗、烧杯.
(3)聚氯乙烯是生活中常用的塑料.工业生产聚氯乙烯的一种工艺路线如下:
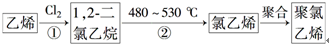
反应①的化学方程式为H2C=CH2+Cl2→CH2ClCH2Cl,反应类型为加成反应,反应②的反应类型为消去反应.
(4)某有机物中各元素的质量分数是:碳49.5%,氢5.20%,氧16.5%,氮28.9%,该有机物的实验式为C4H5ON2.
(Ⅰ)试剂:a.浓硫酸 b.氢氧化钠 c.生石灰 d.水 e.浓溴水
(Ⅱ)方法:A.洗气 B.分液 C.蒸馏
| 要提纯的物质 (杂质) | 乙醇 (水) | 乙炔(H2S) | 溴苯 (溴) |
| 选用试剂 | |||
| 分离方法 | 1 |
(3)聚氯乙烯是生活中常用的塑料.工业生产聚氯乙烯的一种工艺路线如下:
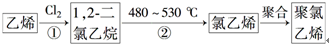
反应①的化学方程式为H2C=CH2+Cl2→CH2ClCH2Cl,反应类型为加成反应,反应②的反应类型为消去反应.
(4)某有机物中各元素的质量分数是:碳49.5%,氢5.20%,氧16.5%,氮28.9%,该有机物的实验式为C4H5ON2.