题目内容
9.过碳酸钠(2Na2CO3•3H2O2)是一种集洗涤、漂白、杀菌于一体的氧系漂白剂.已知:①过碳酸钠具有Na2CO3和H2O2的性质.
②2Na2CO3(aq)+3H2O2(aq)?2Na2CO3•3H2O2 (s)△H<0
③50℃时,2Na2CO3•3H2O2 (s) 开始分解
某兴趣小组制备过碳酸钠的装置示意图如图1所示:
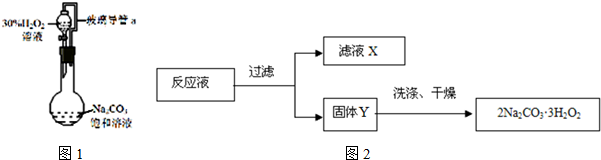
请回答下列问题:
(1)图1中玻璃导管a的作用是平衡压强,使H2O2溶液顺利流下
(2)本实验的关键是控制温度,用该装置制备过碳酸钠有不足之处,下列改进措施可行的是AB(填序号).
A、缓慢滴加H2O2溶液 B、冷水浴 C、用酒精灯加热
(3)将实验改进后按如图2所示流程可获得过碳酸钠产品
①洗涤固体Y时选用无水乙醇作为洗涤剂的目的是减少过碳酸钠的溶解损失,并带走水份利于干燥
②在滤液X中加入适量中加入适量NaCl固体可析出过碳酸钠,原因是增大钠离子浓度,降低过碳酸钠的溶解度
(4)下列物质中,会引起过碳酸钠失效的有AB.
A.Na2SB.FeCl3C.Na2SiO3 D.NaHCO3
(5)过碳酸钠产品中往往含有少量碳酸钠,可用重量法测定过碳酸钠的质量分数;其操作步骤:取m1g样品→溶解→沉淀反应→过滤→洗涤→干燥→称量m2g.
①写出沉淀反应的离子方程式Ba2++CO32-=BaCO3↓
②产品中过碳酸钠质量分数的表达式为:$\frac{314({m}_{1}-\frac{106{m}_{2}}{197})}{102{m}_{1}}$.
③结果与分析:主要影响因素是沉淀是否完全及过碳酸钠有无分解.
分析 本题是利用纯碱和过氧化氢制备过碳酸钠的实验操作与评价,既考查了反应原理,又考查了实验的注意点及混合物的分离与提纯,重点关注过碳酸钠(2Na2CO3•3H2O2)的性质,要防分解、防变质及提高产品产量与纯度,关于样品质量分数的计算可结合碳原子的守恒和固体质量和,以物质的量作为基本单位进行计算,据此解答;
(1)恒压滴液漏斗中的支管主要作用是保持压强平衡利于液体流下;
(2)此反应为放热反应,为防止过碳酸钠分解,可以通过控制反应速率和降温的方法来控制温度;
(3)①洗涤固体Y时选用无水乙醇作为洗涤剂,减少固体的溶解,同时还起到干燥的效果;
②根据溶解平衡的移动,增大钠离子浓度可促进过碳酸钠沉淀;
(4)a、Na2S会被过碳酸钠氧化;
b、醋酸和碳酸钠反应;
c、碳酸氢钠和过碳酸钠不反应;
(5)①沉淀反应是碳酸根离子利用加入氯化钡形成沉淀碳酸钡;
②沉淀法测定过碳酸钠质量分数需要称量样品质量和沉淀质量,计算得到过碳酸钠质量分数;
③样品的纯度可结合沉淀反应是否完全及过碳酸钠有无分解等角度考虑;
解答 解:(1)恒压滴液漏斗中的支管主要作用是保持压强平衡利于液体流下,故答案为:平衡压强,使H2O2溶液顺利流下;
(2)可以利用冰水混合物给反应容器降温,也可以调慢滴加过氧化氢的速度,故答案为:AB;
(3)①用乙醇洗涤过碳酸钠可减少固体的溶解,同时还能起干燥作用,故答案为:减少过碳酸钠的溶解损失,并带走水份利于干燥;
②滤液X中加入适量中加入适量NaCl固体,是为了增加钠离子浓度,促进过碳酸钠溶解平衡逆向移动,得到更多的沉淀,故答案为:增大钠离子浓度,降低过碳酸钠的溶解度;
(4)A、Na2S会被过碳酸钠氧化,使过碳酸钠失效,符合;
B、醋酸和碳酸钠反应,使过碳酸钠失效,符合;
C、碳酸氢钠和过碳酸钠不反应,不符合;
故答案为:AB;
(5)①样品中的碳酸钠加入氯化钡后滤液钡离子沉淀碳酸根离子,反应的离子方程式为:Ba2++CO32-=BaCO3↓,故答案为:Ba2++CO32-=BaCO3↓;
②实验过程中直接测定的物理量为样品的质量m1g、沉淀的质量m2g,沉淀物质的量=$\frac{{m}_{2}g}{197g/mol}$,设过碳酸钠物质的量为x,含有的碳酸钠物质的量为y,依据碳元素守恒得到2x+y=$\frac{{m}_{2}}{197}$、314x+106y=m1 ,x=$\frac{{m}_{1}-\frac{{m}_{2}×106}{197}}{102}mol$;过碳酸钠质量分数=$\frac{x×314}{a}=\frac{314({m}_{1}-\frac{106{m}_{2}}{197})}{102{m}_{1}}$,故答案为:$\frac{314({m}_{1}-\frac{106{m}_{2}}{197})}{102{m}_{1}}$.
③可能影响纯度分析的是沉淀时有没有将碳酸钠完全沉淀,或操作过程中有没有影响过碳酸钠的分解,故答案为:主要影响因素是沉淀是否完全及过碳酸钠有无分解.
点评 本题以物质制备为载体,考查了元素及化合物的知识,重视基础知识的检查,试题难度中等,主要难点是样品纯度计算,对学生分析问题解决问题的能力提高有帮助,还能促进学生关注双基的复习.

在温度相同、容积均为2L的3个恒容密闭容器中,按不同方式投入反应物,保持恒温,测得反应达到平衡时的有关数据如下,下列说法正确的是
(已知N2(g)+3H2(g)=2NH3(g) △H=-92. 4kJ·mol-1)
容器 | 甲 | 乙 | 丙 |
反应物投入量 | 1mol N2、3mol H2 | 2mol N2、6mol H2 | 2mol NH3 |
NH3的浓度( mol·L-1) | c1 | c2 | c3 |
反应的能量变化 | 放出Q1kJ | 放出Q2kJ | 吸收Q3kJ |
体系压强(Pa) | p1 | p2 | p3 |
反应物转化率 | α1 | α2 | α3 |
A.2p1=2p3<p2 B.α2+α3<1
C.达到平衡时乙容器中NH3的体积分数最大 D.Q3+Q1>92.4

部分氢氧化物开始沉淀和完全沉淀的pH如下表
| 氢氧化物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 |
| 开始沉淀的pH | 3.3 | 1.5 | 6.5 | 4.2 |
| 完全沉淀的pH | 5.2 | 3.7 | 9.7 | 6.7 |
(1)滤渣B的主要成分是Fe(OH)3、Al(OH)3(用化学式表示);判断本实验能否调节溶液pH使杂质完全除去而不损失Cu2+,并简述理由否,铝离子全部沉淀时铜离子有沉淀
(2)用离子方程式表示加入绿色氧化剂A的作用2Fe2++H2O2+2H+═2Fe3++2H2O
(3)可向滤液A中加入bd(填字母)调节PH以除去杂质
a.氨水 b.氧化铜 c.氢氧化钠 d.氢氧化铜
(4)从滤液B中提取胆矾的操作包括蒸发浓缩、冷却结晶、过滤、用乙醇洗涤、用滤纸吸干等
(5)测定产品纯度和胆矾中结晶水数目
①沉淀法测定产品纯度
取一定质量的样品溶于蒸馏水,加入足量的BaCl2溶液和稀硝酸,过滤、洗涤、干燥、称重,实验结果发现测得的产品纯度偏高,可能的原因是acd填字母)
a.产品失去部分结晶水 b.产品中混有CuCl2•2H2O
c.产品中混有Al2(SO4)3•12H2O d.产品中混有Na2SO4
②差量法测得结晶水数目
取ag样品盛装在干燥的坩锅里,灼烧至结晶水全部失去,称得无水硫酸铜的质量b g,则胆矾(CuSO4•nH2O)中n值的表达式为$\frac{80(a-b)}{9b}$.

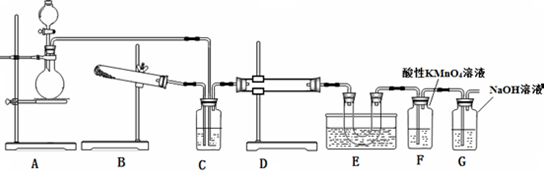
 实验室制备硝基苯的主要步骤如下:
实验室制备硝基苯的主要步骤如下: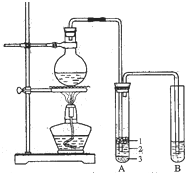 实验室制取少量溴乙烷的装置如图所示.
实验室制取少量溴乙烷的装置如图所示.
 有剧毒
有剧毒