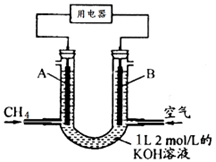
题目内容
在下列各组的比较中,前者比后者大的是
| A.25 ℃时,pH均为2的H2SO4溶液和盐酸中氢离子的物质的量浓度 |
| B.25 ℃时,pH均为2的盐酸和CH3COOH溶液中溶质的物质的量浓度 |
| C.同温度、同浓度的NaCl溶液和氨水的导电能力 |
| D.25 ℃时,pH均为3的盐酸和FeCl3溶液中水的电离程度 |
C
解析

练习册系列答案
相关题目
下列溶液中,微粒浓度关系正确的是( )
| A.含有 NH4+、Cl-、H+、OH-的溶液中,其离子浓度可能是c(Cl-)> c(NH4+)>c(OH-)>c(H+) |
| B.常温下pH=6的醋酸与醋酸钠的混合溶液中c(Na+)>c(CH3COO-) |
| C.0.1 mol·L-1的Na2S溶液中,c(OH-)=c(H+)+c(HS-)+2c(H2S) |
| D.常温下pH=3的一元酸和pH=11的一元碱等体积混合后的溶液中一定是c(OH-)=c(H+) |
对于某酸的酸式盐NaHY的水溶液的下列叙述中,正确的是( )
| A.该酸式盐的水溶液一定显酸性 |
| B.在该盐溶液中,离子浓度为c(Na+)>c(Y2-)>c(HY-)>c(OH-)>c(H+) |
C.若HY-能水解,水解方程式为HY-+H2O Y2-+H3O+ Y2-+H3O+ |
D.若HY-能电离,电离方程式为HY-+H2O Y2-+H3O+ Y2-+H3O+ |
向10 mL 0.1 mol·L-1Na2CO3溶液中逐滴滴加V mL 0.1 mol·L-1HCl溶液,下列有关滴定过程中粒子浓度关系正确的是
A.当V=0时,c(OH-)=c(H+)+c(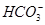 )+c(H2CO3) )+c(H2CO3) |
B.当V=5时,c(Na+)+c(H+)=2c( )+c( )+c(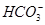 )+c(OH-) )+c(OH-) |
C.当V=10时,c(Cl-)=c( )+c( )+c(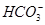 )+c(H2CO3) )+c(H2CO3) |
D.当V=15时,c(Na+)=c(Cl-)>c(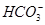 )>c(OH-)>c(H+) )>c(OH-)>c(H+) |
下列说法中正确的是
A.常温下,稀释0.1 mol/L的氨水,溶液中c(OH-)、c( )、c(H+)均减小 )、c(H+)均减小 |
B.常温下,c( )相等的①(NH4)2SO4、②(NH4)2Fe(SO4)2、③NH4Cl、④(NH4)2CO3溶液中,溶质物质的量浓度大小关系是:②<①<④<③ )相等的①(NH4)2SO4、②(NH4)2Fe(SO4)2、③NH4Cl、④(NH4)2CO3溶液中,溶质物质的量浓度大小关系是:②<①<④<③ |
| C.pH相等的CH3COONa、NaHCO3和Na2CO3三种溶液:c(CH3COONa)<c(NaHCO3)<c(Na2CO3) |
| D.某温度时水的离子积常数KW=10-13,若将此温度下pH=11的NaOH溶液a L与pH=1的稀硫酸b L混合,若所得混合液pH=2,则a∶b=2∶9 |
下列有关电解质溶液的说法正确的是
| A.在蒸馏水中滴加浓H2SO4,Kw不变 |
B.CH3COOH溶液加水稀释后,溶液中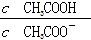 的值减小 的值减小 |
C.Na2CO3溶液中加入少量Ca(OH)2固体, 水解程度减小,溶液的pH减小 水解程度减小,溶液的pH减小 |
| D.NaCl溶液和CH3COONH4溶液均显中性,两溶液中水的电离程度相同 |
一定温度下的难溶电解质AmBn在水溶液中达到溶解平衡时。已知下表数据
| 物质 | Fe(OH)2 | Cu(OH)2 | Fe(OH)3 |
| Ksp(25 ℃) | 8.0×10-16 | 2.2×10-20 | 4.0×10-38 |
| 完全沉淀时的pH值 | ≥9.6 | ≥6.4 | 3~4 |
对含等物质的量的CuSO4、FeSO4、Fe2(SO4)3的混合溶液的说法,不科学的是
A.向该溶液中加少量铁粉不能观察到红色固体析出
B.该溶液中c(SO):[c(Cu2+)+c(Fe2+)+c(Fe3+)]>5∶4
C.向该混合溶液中逐滴加入NaOH溶液,最先看到红褐色沉淀
D.向该溶液中加入适量氯水,并调节pH值到3~4后过滤,得到纯净的CuSO4溶液
两人用同一瓶标准盐酸滴定同一瓶NaOH溶液,甲将锥形瓶用NaOH待测液润洗后,使用水洗过的碱式滴定管取碱液于锥形瓶中,乙则用甲用过的碱式滴定管另取碱液于刚用水洗过且留有蒸馏水珠的锥形瓶中,其他操作及读数全部正确。下列说法正确的是( )
| A.甲操作正确 | B.乙操作有误 |
| C.甲测定的数值一定比乙小 | D.乙实际测得值较准确 |