题目内容
【题目】铁酸锌(ZnFe2O4)是对可见光敏感的半导体催化剂,其实验室制备原理为:
①ZnSO4+2FeSO4+3Na2C2O4+6H2O![]() ZnFe2(C2O4)3·6H2O↓+3Na2SO4
ZnFe2(C2O4)3·6H2O↓+3Na2SO4
②ZnFe2(C2O4)3·6H2O![]() ZnFe2O4+2CO2 ↑+4CO↑+6H2O
ZnFe2O4+2CO2 ↑+4CO↑+6H2O
回答下列问题:
(1)基态 Fe2+的价层电子排布图为___________.
(2)电离能大小比较:I1(Zn)___________ I1(Cu),I2(Zn)___________ I2 (Cu) (填“>”“<”或“=”)。
(3)Na2SO4 中阴离子的空间构型是___________,该离子中 S 的杂化类型是_____。
(4)CO和N2的分子结构相似,标准状况下,VLCO2和CO的混合气体中含键的物质的量为___________。与CO2互为等电子体的离子有____________(写一种即可)。
(5)ZnCl2、ZnBr2、ZnI2 的熔点依次为283℃、394℃、446℃,其主要原因是___________。
(6)铁和碳组成的某种晶体的晶胞如图所示。面心上铁原子相连构成正八面体。
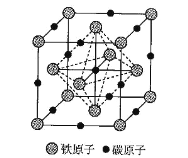
已知该晶体的密度为 dg·cm-3,NA 是阿伏加德罗常数的值。
①该晶体中Fe、C原子的最简比为___________。
②该晶胞中相邻两个面心上铁原子最近的核间距离 D=___________nm(只列计算式)。
【答案】![]() > < 正四面体 sp3
> < 正四面体 sp3 ![]() mol N3-(或NO2+、SCN-等) 它们都形成分子晶体,相对分子质量依次增大,分子间作用力依次增大,所以熔点依次升高 1:1
mol N3-(或NO2+、SCN-等) 它们都形成分子晶体,相对分子质量依次增大,分子间作用力依次增大,所以熔点依次升高 1:1 
【解析】
(1)基态 Fe2+的电子排布式为1s22s22p63s23p63d6,由此可确定Fe2+的价层电子排布图;
(2)Zn的价电子排布式为3d104s2,Cu的价电子排布式为3d104s1,从半满、全满时能量低,第一电离能高进行电离能大小比较;
(3)Na2SO4中阴离子的价层电子对数为4,由此确定空间构型和该离子中 S 的杂化类型;
(4) CO2和CO的分子内都含有2个键,寻找CO2互为等电子体的离子时,可将C、O进行相近原子的替换,电子的差异可用带电荷代替;
(5)ZnCl2、ZnBr2、ZnI2 若为离子晶体,则与熔点关系不相符,所以应形成分子晶体;
(6)①采用均摊法,计算该晶体中Fe、C原子的最简比;
②先求出晶胞中所含有的Fe、C原子数,然后利用密度求体积,进而求出晶胞的边长,最后可利用小三角形,计算该晶胞中相邻两个面心上铁原子最近的核间距离 D。
(1)基态 Fe2+的电子排布式为1s22s22p63s23p63d6,则基态 Fe2+的价层电子排布图为![]() ,答案为:
,答案为:![]() ;
;
(2) Zn的价电子排布式为3d104s2,Cu的价电子排布式为3d104s1,则Zn的4s能级全充满,电子的能量低,失电子所需能量高,而Cu的4s能级半充满,则电离能:I1(Zn)>I1(Cu),Zn+的价电子排布式为3d104s1,Cu+的价电子排布式为3d10,则Cu+的3d能级全充满,失电子所需能量高,所以I2(Zn)< I2 (Cu),答案为:>;<;
(3) Na2SO4中SO42-的价层电子对数为4,则SO42-的空间构型是正四面体,该离子中 S 的杂化类型是sp3,答案为:正四面体;sp3;
(4) CO2和CO的分子内都含有2个键,标准状况下,VLCO2和CO的混合气体中含键的物质的量为![]() =
=![]() mol。依据就近原则,与CO2互为等电子体的离子有N3-(或NO2+、SCN-等),答案为:
mol。依据就近原则,与CO2互为等电子体的离子有N3-(或NO2+、SCN-等),答案为:![]() mol;N3-(或NO2+、SCN-等);
mol;N3-(或NO2+、SCN-等);
(5)从ZnCl2、ZnBr2、ZnI2 的熔点看,三者应形成分子晶体,其主要原因是它们都形成分子晶体,相对分子质量依次增大,分子间作用力依次增大,所以熔点依次升高,答案为:它们都形成分子晶体,相对分子质量依次增大,分子间作用力依次增大,所以熔点依次升高;
(6)①利用均摊法,该晶胞中含Fe原子数为8×![]() +6×
+6×![]() =4,含C原子数为12×
=4,含C原子数为12×![]() +1=4,该晶体中Fe、C原子的最简比为4:4=1:1,答案为:1:1;
+1=4,该晶体中Fe、C原子的最简比为4:4=1:1,答案为:1:1;
②设晶胞的边长为a,则a3=![]() ,a=
,a= nm,该晶胞中相邻两个面心上铁原子最近的核间距离 D=
nm,该晶胞中相邻两个面心上铁原子最近的核间距离 D=![]() ×
×![]() =
= nm,答案为:
nm,答案为: 。
。

【题目】SO2是一种大气污染物,但它在化工和食品工业上却有广泛应用。某兴趣小组同学对SO2的实验室制备和性质实验进行研究。
(1)甲同学按照教材实验要求设计如图所示装置制取SO2

①本实验中铜与浓硫酸反应的化学方程式是 ______,铜丝可抽动的优点是_______。
②实验结束后,甲同学观察到试管底部出现黑色和灰白色固体,且溶液颜色发黑。甲同学认为灰白色沉淀应是生成的白色CuSO4夹杂少许黑色固体的混合物,其中CuSO4以白色固体形式存在体现了浓硫酸的________性。
③乙同学认为该实验设计存在问题,请从实验安全和环保角度分析,该实验中可能存在的问题是________。
(2)兴趣小组查阅相关资料,经过综合分析讨论,重新设计实验如下(加热装置略):

实验记录 A 中现象如下:
序号 | 反应温度/℃ | 实验现象 |
1 | 134 | 开始出现黑色絮状物,产生后下沉,无气体产生 |
2 | 158 | 黑色固体产生的同时,有气体生成 |
3 | 180 | 气体放出的速度更快,试管内溶液为黑色浑浊 |
4 | 260 | 有大量气体产生,溶液变为蓝色,试管底部产生灰白色固体,品红溶液褪色 |
5 | 300 | 同上 |
查阅资料得知: 产物中的黑色和灰白色固体物质主要成分为 CuS、Cu2S 和 CuSO4,其中CuS 和 Cu2S为黑色固体,常温下都不溶于稀盐酸,在空气中灼烧均转化为CuO和SO2。
①实验中盛装浓硫酸的仪器名称为 ____________。
②实验记录表明__________对实验结果有影响,为了得到预期实验现象,在操作上应该____________。
③装置C 中发生反应的离子方程式是 ___________________。
④将水洗处理后的黑色固体烘干后,测定灼烧前后的质量变化,可以进一步确定黑色固体中是否一定含有 CuS其原理为__________(结合化学方程式解释)。