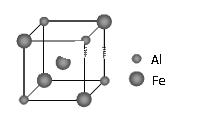
题目内容
【题目】氢气是一种清洁能源,又是合成氨工业的重要原料.
(1)已知:![]()
![]()
甲烷和![]() 反应生成
反应生成![]() 和
和![]() 的热化学方程式为 ______ .
的热化学方程式为 ______ .
(2)工业合成氨的反应原理为![]() 某温度下,把10mol
某温度下,把10mol![]() 与28mol
与28mol![]() 置于容积为10L的密闭容器内,10min时反应达到平衡状态,测得氮气的平衡转化率为
置于容积为10L的密闭容器内,10min时反应达到平衡状态,测得氮气的平衡转化率为![]() ,则10min内该反应的平均速率
,则10min内该反应的平均速率![]() ______
______ ![]() ,则该温度下该反应的平衡常数
,则该温度下该反应的平衡常数![]() ______
______ ![]() 欲增大氮气的平衡转化率,可采取的措施有 ______
欲增大氮气的平衡转化率,可采取的措施有 ______ ![]() 写一种措施即可
写一种措施即可![]() .
.
【答案】 CH4(g)+2H2O(g)=CO2(g)+4H2(g)△H=+165.0kJ/mol 0.18 3.6 增加氢气的浓度或分离出氨气或降温
【解析】(1)①CH4(g)+H2O(g)=CO(g)+3H2(g)△H=206.2kJmol-1;②CH4(g)+CO2(g)=2CO(g)+2H2(g)△H=247.4kJmol-1;结合盖斯定律①×2-②得到CH4(g)与H2O(g)反应生成CO2(g)和H2(g)的热化学方程式为:CH4(g)+2H2O(g)=CO2(g)+4H2(g)△H=+165.0kJmol-1,故答案为:CH4(g)+2H2O(g)=CO2(g)+4H2(g)△H=+659.8kJmol-1。
(2)N2(g)+3H2(g)2NH3(g)
初始浓度:1 2.80
变化浓度:0.6 1.8 1.2
平衡浓度:0.4 1.0 1.2
则10min内该反应的平均速率![]() ,
,![]() ,欲增大氮气的平衡转化率,可以增加氢气的物质的量,或是降低温度等,故答案为:0.18;3.6;增加氢气的物质的量(降低温度)。
,欲增大氮气的平衡转化率,可以增加氢气的物质的量,或是降低温度等,故答案为:0.18;3.6;增加氢气的物质的量(降低温度)。

练习册系列答案
 提分百分百检测卷系列答案
提分百分百检测卷系列答案 宝贝计划期末冲刺夺100分系列答案
宝贝计划期末冲刺夺100分系列答案 能考试全能100分系列答案
能考试全能100分系列答案
相关题目