题目内容
5.下列烷烃只有两种同分异构体的是( )| A. | 丁烷 | B. | 丙烷 | C. | 乙烷 | D. | 戊烷 |
分析 根据烷烃中碳原子数目≤3的烷烃不存在同分异构体现象,从丁烷开始才出现同分异构现象,写出丁烷、戊烷同分异构体进行判断.
解答 解:烷烃中碳原子数目≤3的烷烃不存在同分异构体现象,即乙烷、丙烷都无同分异构体,从丁烷开始才出现同分异构体,丁烷既可表示正丁烷,也可表示异丁烷,戊烷有正戊烷、异戊烷和新戊烷三种,故选A.
点评 本题考查同分异构体的书写,难度较小,同分异构体一般考虑碳链异构、官能团位置异构、官能团种类异构.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
10.下列说法正确的是(NA表示阿伏加德罗常数的值)( )
| A. | 常温常压下,18g NH4+所含的电子数为10NA | |
| B. | 56g金属铁与足量的稀盐酸反应时转移的电子数为3NA | |
| C. | 标准状况下,22.4L氧气所含的氧原子数为2 NA | |
| D. | 1 mol由Na2O2和Na2O组成的混合物,其中的钠离子数为4 NA |
17.有些垃圾可以用卫生填埋、焚烧、堆肥的方法处理.下列垃圾中,不适合用这样的方法处理的是( )
| A. | 厨余垃圾 | B. | 废旧电池 | C. | 餐巾纸 | D. | 纯棉纺织品 |
15.镁、铝是常见的两种金属,它们组成合金是现代科技的重要材料.
I、镁的金属性比铝的更强.
(1)请从原子结构的角度解释镁的金属性比铝强的原因.答:镁铝原子核外电子层数相同,与铝相比,镁原子半径更大,失去电子能力更强.
II、现有四块相同的镁铝合金(假设质量均为Xg).为测定该合金中铝的质量分数,四个同学各取一块合金,并按下述四种不同的方案进行实验:
甲:将合金溶于足量的盐酸,测得生成气体的体积为VL(标况下);
乙:将合金溶于足量的NaOH溶液中,测得剩余固体的质量为Yg;
丙:将合金溶于足量的盐酸,再加入足量的NaOH溶液后过滤,测得沉淀质量为Zg;
丁:将合金溶于足量的盐酸,再加入足量的氨水后过滤,测得沉淀质量为Wg;
(2)乙方案中反应的化学方程式为2Al+2NaOH+2H2O=2NaAlO2+H2↑.
(3)四种方案中,可测出合金中铝的质量分数的是甲、乙、丙、丁(填实验方案代号).
(4)选择一种可测出合金中铝的质量分数的方案,并利用相关量,计算该合金中铝的质量分数,并填入下表中:
(5)方案乙中,浸泡于氢氧化钠溶液中的合金与氢氧化钠溶液构成了原电池.对于该原电池,其负极的电极反应式为2Al+8OH--6e-=2AlO2-+4H2O.
I、镁的金属性比铝的更强.
(1)请从原子结构的角度解释镁的金属性比铝强的原因.答:镁铝原子核外电子层数相同,与铝相比,镁原子半径更大,失去电子能力更强.
II、现有四块相同的镁铝合金(假设质量均为Xg).为测定该合金中铝的质量分数,四个同学各取一块合金,并按下述四种不同的方案进行实验:
甲:将合金溶于足量的盐酸,测得生成气体的体积为VL(标况下);
乙:将合金溶于足量的NaOH溶液中,测得剩余固体的质量为Yg;
丙:将合金溶于足量的盐酸,再加入足量的NaOH溶液后过滤,测得沉淀质量为Zg;
丁:将合金溶于足量的盐酸,再加入足量的氨水后过滤,测得沉淀质量为Wg;
(2)乙方案中反应的化学方程式为2Al+2NaOH+2H2O=2NaAlO2+H2↑.
(3)四种方案中,可测出合金中铝的质量分数的是甲、乙、丙、丁(填实验方案代号).
(4)选择一种可测出合金中铝的质量分数的方案,并利用相关量,计算该合金中铝的质量分数,并填入下表中:
| 你选择的方案 | 合金中铝的质量分数 |
| 甲或乙或丙或丁 | $\frac{3.214V}{X}-3$或$\frac{X-Y}{X}$或$\frac{29X-12Z}{29X}$或$\frac{36W-87X}{17X}$ |
 .
.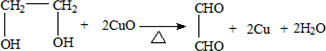 .
. .
.


 ;
;