题目内容
【题目】某工厂排放的工业废水中含Fe3+、Al3+、Cu2+,为了减少环境污染,变废为宝,利用废铁屑和其它化学试剂进行如下操作,得到了Fe2O3、Al2O3和金属Cu。
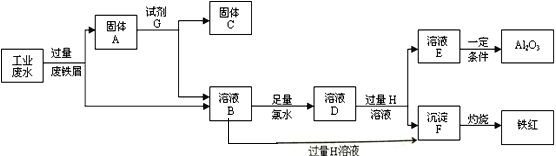
请回答:(1)固体A的成分是____________(用化学式表示)。
(2)溶液B→沉淀F的现象是__________________,沉淀产生此现象的原理是_____________________________ (用化学方程式表示)。
(3)写出下列反应的离子方程式:
工业废水→溶液B中Fe3+发生的反应:____________________________________。D→E:____________________________________。
(4)溶液E焰色反应呈黄色,试剂H是___________________ (用化学式表示)。
(5)小明认为由溶液B→溶液D的过程并不符合绿色化学,所以将氯水换成了H2O2溶液,在该转化过程中若转移2mol 电子,则消耗质量分数为30%的H2O2溶液的质量为________g(精确到0.1g)。
【答案】 Fe Cu 沉淀由白色变成灰绿色,再变成红褐色沉淀 4Fe(OH)2+O2+2H2O=4Fe(OH)3 2Fe3++Fe=3Fe2+ Al3++4OH-=AlO2-+2H2O NaOH 113.3g
【解析】由流程可知,先加过量铁发生的反应依次为:2Fe3++Fe=3Fe2+、Fe+Cu2+=Cu+2Fe2+,由于铁过量可知固体A中含Fe和Cu;试剂G为盐酸,Cu与盐酸不反应,则固体C为Cu,溶液B中含Al3+、Fe2+,加氯水,+2价的铁离子被氯水氧化:2Fe2++Cl2=2Fe3++2Cl-;再加过量D为强碱,溶液E为偏铝酸盐,沉淀F为氢氧化铁,氢氧化铁高温分解生成氧化铁和水。偏铝酸盐最终转化为氢氧化铝,氢氧化铝分解生成氧化铝。
(1)根据以上分析可知固体A的成分是Fe、Cu。(2)由于氢氧化亚铁易被氧化为氢氧化铁,则溶液B→沉淀F的现象是沉淀由白色变成灰绿色,再变成红褐色沉淀,反应的化学方程式为4Fe(OH)2+O2+2H2O=4Fe(OH)3。(3)根据以上分析可知工业废水→溶液B中Fe3+发生的反应为2Fe3++Fe=3Fe2+。D→E反应的离子方程式为Al3++4OH-=AlO2-+2H2O。(4)溶液E的焰色反应呈黄色,说明试剂H是NaOH。(5)1mol双氧水得到2mol电子,该转化过程中若转移2mol电子,则消耗双氧水是1mol,质量是34g,所以消耗质量分数为30%的H2O2溶液的质量为34g÷0.3=113.3g。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案