题目内容
【题目】下表是元素周期表的一部分。表中所列的字母分别代表一种化学元素。

试回答下列问题:
(1)I的最高化合价为___,I的元素名称为___。
(2)写出基态时K元素原子的电子排布式___,J元素原子的外围电子排布式___。
(3)下列对比正确的是___。
a.原子半径H>G>B>A
b.第一电离能E>D>C>B
c.电负性A>H>G>Q
d.最高价氧化物的水化物酸性B>A>H>G
(4)下列关于元素在元素周期表中的位置以及元素原子的外围电子排布特点的有关叙述不正确的是___。
a.L位于元素周期表第五周期ⅠA族,属于s区元素
b.O位于元素周期表第七周期Ⅷ族,属于ds区元素
c.M的外围电子排布式为6s1,属于ds区元素
d.H所在族的外围电子排布式为ns2np2,属于p区元素
【答案】+6 铬 1s22s22p63s23p63d104s1 3d64s2 cd bc
【解析】
由元素在周期表中位置,可知P为H、A为C、B为N、C为O、D为F、E为Ne、F为Mg、G为Al、H为Si、I为Cr、J为Fe、K为Cu、Q为Ga、L为Rb、N为At。
(1)I为Cr元素,名称为铬,原子序数为24,价电子排布式为3d54s1,最高正化合价为+6,故答案为:+6;铬;
(2)K为Cu,原子核外有29个电子,核外电子排布式为1s22s22p63s23p63d104s1;J为Fe,原子核外有26个电子,核外电子排布式为1s22s22p63s23p63d64s2,则外围电子排布式为3d64s2,故答案为:1s22s22p63s23p63d104s1;3d64s2;
(3)a.同周期自左而右原子半径减小、同主族自上而下原子半径增大,故原子半径G>H>A>B,故a错误;
b.同周期自左而右第一电离能呈增大趋势,但IIA族、VA元素的第一电离能高于同周期相邻元素的,故第一电离能E>D>B>C,故b错误;
c.同周期自左而右电负性增大、同主族自上而下电负性减小,故电负性A>H>G>Q,故c正确;
d.非金属性B>A>H>G,则最高价氧化物的水化物酸性B>A>H>G,故d正确;
故答案为:cd;
(4)a.由L的位置可知,L位于元素周期表中第五周期ⅠA族,属于s区元素,故a正确;
b.由O的位置可知,O位于元素周期表中第七周期Ⅷ族,属于d区元素,故b错误;
c.M位于IB族,外围电子排布式为5d106s1,属于ds区元素,故c错误;
d.H处于IVA族,所在族的外围电子排布式为ns2np2,属于p区元素,故d正确;
故答案为:bc。

 优加精卷系列答案
优加精卷系列答案【题目】利用水钴矿(主要成分为Co2O3,含少量Fe2O3、Al2O3、MnO、MgO、CaO、SiO2等)可以制取多种化工试剂,以下为草酸钴晶体和氯化钴晶体的制备流程,回答下列问题:
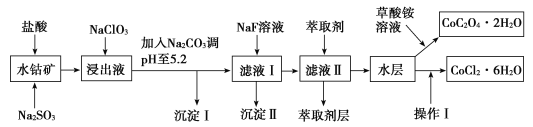
已知:①浸出液中含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Al3+、Mg2+、Ca2+等。
②沉淀Ⅰ中只含有两种沉淀。
③流程中部分阳离子以氢氧化物形式沉淀时溶液的pH见表:
沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
开始沉淀 | 2.7 | 7.6 | 7.6 | 4.0 | 7.7 |
完全沉淀 | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
(1)浸出过程中加入Na2SO3目的是___。
(2)NaClO3在浸出液中发生反应的离子方程式为___。
(3)加入Na2CO3调pH至5.2,目的是___;萃取剂层含锰元素,则沉淀Ⅱ的主要成分为__。
(4)操作Ⅰ包括:将水层加入浓盐酸调整pH为2~3,___、__、过滤、洗涤、减压烘干等过程。
(5)为测定粗产品中CoCl2·6H2O的含量,称取一定质量的粗产品溶于水,加入足量硝酸酸化的硝酸银溶液,过滤、洗涤、干燥,测沉淀质量。通过计算发现粗产品中CoCl2·6H2O质量分数大于100%,其原因可能是___(回答一条原因即可)。
(6)将5.49g草酸钴晶体(CoC2O4·2H2O)置于空气中加热,受热过程中不同温度范围内分别得到一种固体物质,其质量如下表。
温度范围/℃ | 固体质量/g |
150~210 | 4.41 |
290~320 | 2.41 |
经测定,整个受热过程,只产生水蒸气和CO2气体,则290~320℃温度范围,剩余的固体物质化学式为____。[已知:CoC2O4·2H2O的摩尔质量为183g·mol1]


