题目内容
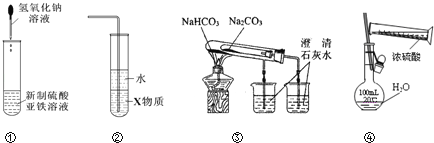
【题目】利用如图所示装置进行下列实验,不能达到相应实验目的的是( )
选项 | ① | ② | ③ | 实验目的 |
|
A | 稀硫酸 | Na2S | AgCl的浊液 | 验证Ag2S比AgCl难溶 | |
B | 浓硝酸 | Cu片 | NaOH溶液 | 探究浓硝酸具有氧化性 | |
C | 硫酸 | Na2SO3 | 酸性KMnO4溶液 | 探究SO2具有还原性 | |
D | 浓硝酸 | Na2CO3 | Na2SiO3溶液 | 验证酸性:硝酸>碳酸>硅酸 |
A.AB.BC.CD.D
【答案】D
【解析】
A. 在装置②中H2SO4与Na2S发生复分解反应产生H2S气体,气体进入③中与AgCl悬浊液发生反应产生Ag2S黑色沉淀,从而可证明Ag2S比AgCl更难溶,A正确;
B. 浓硝酸与Cu反应产生Cu(NO3)2、红棕色气体NO2、H2O,NaOH溶液吸收NO2气体,变为NaNO3、NaNO2和水,从而防止了大气污染。在HNO3中N元素为+5价,反应后变为NO2中的+4价,元素化合价降低,得到电子,被还原,从而可证明浓硝酸具有氧化性,B正确;
C. 硫酸与Na2SO3发生复分解反应产生SO2气体,SO2气体通入到酸性KMnO4溶液中,看到溶液紫色褪色,可证明SO2具有还原性,C正确;
D. 浓硝酸与Na2CO3在溶液中发生复分解反应产生CO2气体,证明酸性:HNO3>H2CO3;但由于浓硝酸具有挥发性,挥发的硝酸蒸气进入装置③中,会发生反应:2HNO3+Na2SiO3=H2SiO3↓+ 2NaNO3,得到结论酸性:HNO3>H2SiO3;在③中CO2气体也会发生反应:CO2+H2O+Na2SiO3=H2SiO3↓+ Na2CO3,产生白色硅酸沉淀,因此不能证明白色沉淀是那种物质反应产生,故不能得到结论:酸性:HNO3>H2CO3> H2SiO3,D错误;
故合理选项是D。

练习册系列答案
 期末好成绩系列答案
期末好成绩系列答案 99加1领先期末特训卷系列答案
99加1领先期末特训卷系列答案 百强名校期末冲刺100分系列答案
百强名校期末冲刺100分系列答案
相关题目