题目内容
如何设计实验探究Zn、Cu和稀硫酸构成的原电池中锌片的腐蚀速率与将锌片直接插入稀硫酸中锌片的腐蚀速率的快慢?
解析:
|
导思:关键比较两套装置的异同,根据原电池的工作原理解释.要弄清Zn、Cu和稀硫酸构成的原电池中锌片、铜片和稀硫酸分别起什么作用,电解质溶液中氢离子、硫酸根离子向哪个方向移动,锌片、氢离子发生什么变化等. 探究:分别做将锌片直接插入稀硫酸中的探究实验以及Zn、Cu和稀硫酸构成的原电池的探究实验,比较现象的异同. 由于Zn失去电子被氧化成Zn2+进入溶液,在锌片附近形成一层阳离子氛围,对溶液中的氢离子起到排斥作用,使氢离子向铜片附近定向移动;溶液中的硫酸根离子则有向锌片定向移动的趋势.故Zn、Cu、稀硫酸构成的原电池中锌片的腐蚀速率比将锌片直接插入稀硫酸中锌片的腐蚀速率快. 其中,铜片起的作用是:当锌片和铜片同时浸入稀硫酸中,由于两种金属的原子失电子的能力不同,会在两者之间形成电势差,当用导线将锌片和铜片连接起来时便会产生电流. |

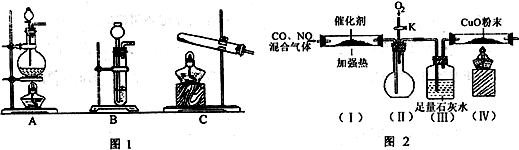
I、某化学课外活动小组对污染大气的部分非金属氧化物进行探究。请根据题目要求回答下列问题。
(1)写出用硝酸制取NO的离子方程式 。
(2)查资料得知,HCOOH CO+H2O。实验室有如图l所示的装置,制取CO气体可选用的装置为
CO+H2O。实验室有如图l所示的装置,制取CO气体可选用的装置为
(填序号),实验室利用该装置还可制取的常见气体有 (写一种气体的分子式)。
(3)查资料得知,利用催化剂可使汽车尾气中的一氧化碳和氮氧化物大部分发生反应转化为二氧化碳和氮气。该小组在实验室模拟汽车尾气处理,设计了如图2所示装置(部分夹持和装置已略去)。


①实验前,关闭旋塞K,先通氮气排净装置中的空气,其目的是 。
②装置(III)的主要作用是 。
③该套装置中有不完善之处,还应在装置(Ⅳ)后补充 装置。
II、该课外小组设计的从ZnSO4、FeCl3的混合溶液中制取ZnSO4·7H2O过程如下:
a.在混合液中加入6 mol/L NaOH溶液,至pH=8为止。
b.过滤后得到沉淀,用蒸馏水多次洗涤沉淀。
c.向洗涤后的沉淀中加入2 mol/L的硫酸,保持溶液的pH在4~6,加热煮沸,趁热过滤,滤液即为ZnSO4溶液。
d.滤液中加入2 mol/L的硫酸,使其pH=2。
已知部分阳离子以氢氧化物的形式开始沉淀至完全沉淀时溶液的pH见下表,回答下列问题:
|
沉淀物 |
Fe(OH)3 |
Zn(OH)2 |
|
pH |
1.5~3.2 |
6.4~8.0 |
(1)步骤b中如何检测沉淀已经洗涤干净 。
(2)步骤d中加入硫酸,使其pH=2的目的是 ;要制得ZnSO4·7H2O的步骤d还缺少的操作是 ,所用的主要硅酸盐仪器是 。
某化学课外活动小组在实验室做了如下一系列实验:
(1)该小组设计了如图所示的一套气体发生、收集和尾气吸收装置以探究装置的多功能
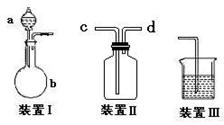 性。
性。
① 甲同学认为装置Ⅰ可作为实验室制氧气的快速发生器,则装置Ⅰ的a仪器中可加
入 或 ,装置Ⅱ从 管口进气即可作为O2的收集装置。
 ② 乙同学认为利用装置Ⅱ,可收集NO,试简述操作方法:
② 乙同学认为利用装置Ⅱ,可收集NO,试简述操作方法:
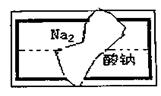
(2)小组在整理实验室的化学试剂时,发现一盛有
无色溶液的试剂瓶。标签破损(如图),请你根
据已掌握的知识,对该试剂可能是什么物质的溶
液作出二种猜想,并设计实验验证,写出任一种
的实验操作、现象和结论。
| 猜想物质的化学式 | 检验所需要的试剂 | 操作、现象和结论 | |
| ① | |||
| ② |
|
(3)该小组从ZnSO4、FeCl3的混合溶液中制取ZnSO4?7H2O过程如下:
a.在混合液中加入6 mol?L―1NaOH溶液,至pH=8为止。
b.过滤后得到沉淀,用蒸馏水多次洗涤沉淀。
c.向洗涤后的沉淀中加入2 mol?L―1的硫酸,保持溶液的pH在4~6,加热煮沸,
趁热过滤,滤液即为ZnSO4溶液
d.滤液中注入2 mol?L―1的硫酸,使其pH保持为2……
已知部分阳离子以氢氧化物的形式开始沉淀至完全沉淀时溶液的pH见下表,回答下列
问题:
| 沉淀物 | Fe(OH)3 | Zn(OH)2 |
| pH | 1.5~3.2 | 6.4~8.0 |
① 步骤a中用pH试纸控制溶液pH=8,使用pH试纸的操作是 ;步骤b中如何
检验沉淀已经洗涤干净? 。
② 要制得ZnSO4?7H2O的步骤d还缺少的操作是 ,所用的主要硅酸盐
仪器是 。