题目内容
9.在容积为3L的密闭容器中进行的反应:4A(g)+5B(g)?2C(g).开始时A为8mol,B为12mol,2s后A为2mol,则以B表示该反应的化学反应速率为:1.25mol•L-1•s-1,以C表示该反应的化学反应速率为0.5mol•L-1•s-1.分析 开始时A为8mol,B为12mol,2s后A为2mol,则参加反应的A的物质的量=(8-2)mol=6mol,根据A、B的关系式知,参加反应的B的物质的量是7.5mol,根据v=$\frac{\frac{△n}{V}}{△t}$计算B的反应速率,再结合同一可逆反应中同一时间段内各物质的反应速率之比等于其计量数之比计算C的反应速率.
解答 解:开始时A为8mol,B为12mol,2s后A为2mol,则参加反应的A的物质的量=(8-2)mol=6mol,根据A、B的关系式知,参加反应的B的物质的量是7.5mol,v(B)=$\frac{\frac{△n}{V}}{△t}$=$\frac{\frac{7.5mol}{3L}}{2s}$=1.25mol•L-1•s-1,再结合同一可逆反应中同一时间段内各物质的反应速率之比等于其计量数之比计算C的反应速率=$\frac{2}{5}$v(B)=$\frac{2}{5}$×1.25mol•L-1•s-1=0.5mol•L-1•s-1,故答案为:1.25mol•L-1•s-1;0.5mol•L-1•s-1 .
点评 本题考查反应速率的有关计算,明确反应速率公式中各个物理量的关系及计量数和速率的关系即可解答,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
5.能正确表示下列反应的离子方程式是( )
| A. | 磁性氧化铁溶于盐酸:Fe2O3+6H+=2Fe3++3H2O | |
| B. | 淀粉碘化钾溶液在空气中变蓝:4I-+O2+2H2O=2I2+4OH- | |
| C. | Na2O2与H2O反应制备O2:Na2O2+H2O=2Na++2OH-+O2↑ | |
| D. | 氯气溶于水制备次氯酸:Cl2+H2O=2H++Cl-+ClO- |
6.一块11.0g的铁铝合金,加入一定量的稀硫酸后合金完全溶解,然后加H2O2至溶液中无Fe2+存在,加热除去多余的H2O2,当加入200mL 6mol•L-1 NaOH溶液时沉淀量最多,且所得沉淀质量为26.3g,下列说法不正确的是( )
| A. | 该合金中铁的质量为5.6g | |
| B. | 合金与稀硫酸反应共生成0.45mol H2 | |
| C. | 该合金与足量氢氧化钠反应,转移的电子数为0.6NA | |
| D. | 所加的稀硫酸中含0.6molH2SO4 |
4.CPAE是蜂胶的主要活性成分,由咖啡酸合成CPAE路线如下:

下列分析正确的是( )

下列分析正确的是( )
| A. | 1molCPAE与NaOH溶液,浓溴水和氢气反应时最多消耗的NaOH、Br2和H2的物质的量分别是3mol、4mol和7mol | |
| B. | 咖啡酸分子中至少有9个碳原子共平面 | |
| C. | 咖啡酸、苯乙醇及CPAE都能发生取代,加成和消去反应 | |
| D. | 用FeCl3溶液可以检测上述反应中是否有CPAE生成 |
14.常温下,下列各组离子在指定溶液中能大量共存的是( )
| A. | pH=1的溶液中:Fe2+、NO3-、Cl-、Na+ | |
| B. | Na2S溶液中:SO42-、K+、Cl-、Cu2+ | |
| C. | c(H+)=1.0×10-13 mol•L-1溶液中:C6H5O-、K+、SO42-、Br- | |
| D. | 能使甲基橙呈红色的溶液中:Na+、AlO2-、NO3-、HCO3- |
18.芳香化合物C8H8O2属于酯的有( )种.
| A. | 3 | B. | 4 | C. | 5 | D. | 6 |
19.以下是关于化学反应2SO2+O2?2SO3的两个素材:
素材1:某温度和压强下,2升容器中,不同时间点测得密闭体系中三种物质的物质的量
素材2:反应在不同条件下进行时SO2的转化率:(SO2的转化率是反应的SO2占起始SO2的百分数,SO2的转化率越大,化学反应的限度越大)
根据以上的两个素材回答问题:
(1)根据素材1中计算20~30s期间,用二氧化硫表示的化学反应平均速率为0.0075mol•L-1•s-1.
(2)根据素材2中分析得到,提高该化学反应限度的途径有增大压强或在一定范围内降低温度.
(3)根据素材1、素材2中分析得到,要实现素材1中SO2的转化率需控制的反应条件是温度为600℃,压强为1MPa.
素材1:某温度和压强下,2升容器中,不同时间点测得密闭体系中三种物质的物质的量
| 时间(s)物质的量(mol)物质 | 0 | 10 | 20 | 30 | 40 | 0 | 60 | 70 |
| SO2 | 1 | 0.7 | 0.5 | 0.35 | 0.2 | 0.1 | 0.1 | 0.1 |
| O2 | 0.5 | 0.35 | 0.25 | 0.18 | 0.1 | 0.05 | 0.05 | 0.05 |
| SO3 | 0 | 0.3 | 0.5 | 0.65 | 0.8 | 0.9 | 0.9 | 0.9 |
| 压强转化率温度 | 0.1MPa | 0.5MPa | 1MPa | 10MPa |
| 400℃ | 99.2 | 99.6 | 99.7 | 99.9 |
| 500℃ | 93.5 | 96.9 | 97.8 | 99.3 |
| 600℃ | 73.7 | 85.8 | 90.0 | 96.4 |
(1)根据素材1中计算20~30s期间,用二氧化硫表示的化学反应平均速率为0.0075mol•L-1•s-1.
(2)根据素材2中分析得到,提高该化学反应限度的途径有增大压强或在一定范围内降低温度.
(3)根据素材1、素材2中分析得到,要实现素材1中SO2的转化率需控制的反应条件是温度为600℃,压强为1MPa.
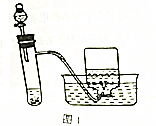
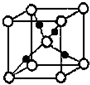 绿矾(FeSO4•7H2O)和胆矾(CuSO4•5H2O)都是重要的化工原料.回答下列问题:
绿矾(FeSO4•7H2O)和胆矾(CuSO4•5H2O)都是重要的化工原料.回答下列问题: