题目内容
Cu+在酸性溶液中不稳定,可发生自身氧化还原反应生成Cu2+和Cu。现有浓硫酸、浓硝
 酸、稀硫酸、稀硝酸、FeCl3稀溶液及pH试纸,简述如何用简便的实验方法来检验CuO经
酸、稀硫酸、稀硝酸、FeCl3稀溶液及pH试纸,简述如何用简便的实验方法来检验CuO经
 氢气还原所得红色产物中是否含有碱性氧化物Cu2O。
氢气还原所得红色产物中是否含有碱性氧化物Cu2O。
 酸、稀硫酸、稀硝酸、FeCl3稀溶液及pH试纸,简述如何用简便的实验方法来检验CuO经
酸、稀硫酸、稀硝酸、FeCl3稀溶液及pH试纸,简述如何用简便的实验方法来检验CuO经 氢气还原所得红色产物中是否含有碱性氧化物Cu2O。
氢气还原所得红色产物中是否含有碱性氧化物Cu2O。取少量待检样品放入稀硫酸,振荡,若溶液变为蓝色,说明样品中有Cu2O,若溶液不变色,说明产物中无Cu2O。
 由题给信息可知,Cu2O是碱性氧化物,可溶于酸溶液:Cu2O+2H+=2Cu++H2O;而Cu+在酸溶液中不稳定,自身歧化成Cu2+和Cu。2Cu+=Cu2++Cu。题给试剂中,浓硫酸、浓硝酸、稀硝酸、FeCl3稀溶液均显酸性,且都能与Cu反应生成Cu2+,如果选用这些试剂,它们和样品反应后的溶液都呈蓝色(Cu2+),但分不清是与Cu还是与Cu2O反应产生的Cu2+,故无法确证样品中是否含有Cu2O。根据以上分析,选用的试剂必须符合两个条件,一是呈酸性,二是不能与Cu反应。在题给试剂中只有稀硫酸符合。
由题给信息可知,Cu2O是碱性氧化物,可溶于酸溶液:Cu2O+2H+=2Cu++H2O;而Cu+在酸溶液中不稳定,自身歧化成Cu2+和Cu。2Cu+=Cu2++Cu。题给试剂中,浓硫酸、浓硝酸、稀硝酸、FeCl3稀溶液均显酸性,且都能与Cu反应生成Cu2+,如果选用这些试剂,它们和样品反应后的溶液都呈蓝色(Cu2+),但分不清是与Cu还是与Cu2O反应产生的Cu2+,故无法确证样品中是否含有Cu2O。根据以上分析,选用的试剂必须符合两个条件,一是呈酸性,二是不能与Cu反应。在题给试剂中只有稀硫酸符合。
练习册系列答案
 各地期末复习特训卷系列答案
各地期末复习特训卷系列答案 小博士期末闯关100分系列答案
小博士期末闯关100分系列答案
相关题目



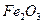 。现以该铁矿石为原料炼铁,若生产过程中铁元素损失4%,计算每生产1.00t生铁(含铁96%),至少需要这种铁矿石多少吨?(保留两位小数)
。现以该铁矿石为原料炼铁,若生产过程中铁元素损失4%,计算每生产1.00t生铁(含铁96%),至少需要这种铁矿石多少吨?(保留两位小数)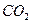 气体
气体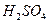 。溶液中,充分反应后,测得的实验数据如下表所示:
。溶液中,充分反应后,测得的实验数据如下表所示: