题目内容
| |||||||||||||||||||||||||||||||||||||||||||||||||
解析:
|
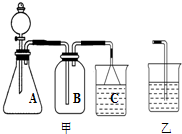
B,因为硝酸对橡皮塞及橡皮管均有强烈的腐蚀作用,A装置中的连接方式均采用了橡皮塞或橡皮管,且A装置的冷凝效果较差(仅靠室温的空气来冷却),故不能很快降低硝酸的温度而使硝酸大量挥发 |
提示:
(2) |
加热方式应始终避免猛火,因为HNO3受热易分解,且温度越高,分解速率越快:4HNO3 |
(3) |
对橡胶制品有强腐蚀作用,见光又易分解的液体,应保存在棕色细口玻璃塞的试剂瓶中.滴瓶由于仍带有橡皮胶头,故也不可选用,该小题应选A项. |
(4) |
不管采用哪套装置,均会产生强腐蚀性的硝酸蒸气,它的逸散会对人产生不良影响,故该实验应在通风橱中进行. |

实验室用浓硫酸与铜的反应制取少量NaHSO3,实验装置如图所示:

(1)装置乙的作用是_____________________。
(2)装置丁的作用是吸收污染空气的SO2气体,其反应的离子方程为 。
(3) SO2 气体有漂白性、还原性和氧化性。将SO2 通入氯水中,SO2表现的是________性,化学反应方程式为 。
(4)反应过程中,将丙中滴管里的品红溶液滴入锥形瓶,若现象为 ,则溶液中的NaOH完全转化为了NaHSO3。
(5)若丙中没有加入品红溶液,则不能准确判断氢氧化钠是否完全转化。现有可供选择的仪器和试剂:烧杯、试管、玻璃棒、胶头滴管; 2 mol/L盐酸、2 mol/L硝酸、1 mol/L氯化钡溶液、l mol/L氢氧化钡溶液、品红溶液、蒸馏水。
请设计实验探究吸收后产物中是否存在NaHSO3 和 Na2SO3,将实验操作、预期的实验现象和结论填在下表中。
|
实验操作 |
预期现象与结论 |
|
步骤1:取少量待测液放入试管中,滴加过量lmol/L氯化钡溶液。静置一段时间后,得到滤液A和固体B。 |
|
|
步骤2:往固体B中加入蒸馏水洗涤沉淀,静置后弃去上层清液,向固体滴入2滴(或少量)品红,再
|
若品红褪色(或有气泡),则
|
|
步骤3:
|
若 则 ; 否则 。 |

 分析解答下列化学实验和计算问题:
分析解答下列化学实验和计算问题: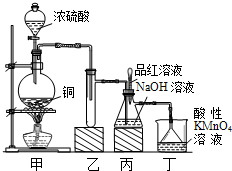 实验室用浓硫酸与铜的反应制取少量NaHSO3,实验装置如图所示:
实验室用浓硫酸与铜的反应制取少量NaHSO3,实验装置如图所示: