题目内容
【题目】在标准状况下:a.6.72LCH4气体
b.3.01×1023个HCl气体分子
c.13.6gH2S气体
d.0.2molNH3
下列对这四种气体的关系从大到小的排列是(用上述序号表示).
①四种气体的物质的量 ;
②标准状况下四种气体的密度 .
【答案】①b>c>a>d;
②b>c>d>a.
【解析】
试题分析:①n=![]() =
=![]() =
=![]() ;
;
②相同条件下气体摩尔体积相等,标况下气体密度=![]() ,根据公式知,气体密度与摩尔质量成正比.
,根据公式知,气体密度与摩尔质量成正比.
解:①n(CH4)=![]() =
=![]() =0.3mol,
=0.3mol,
n(HCl)=![]() =
=![]() =0.5mol,
=0.5mol,
n(H2S)=![]() =
=![]() =0.4mol;
=0.4mol;
n(NH3)=0.2mol;
所以这四种气体的物质的量大小顺序是b>c>a>d,故答案为:b>c>a>d;
②相同条件下气体摩尔体积相等,标况下气体密度=![]() ,根据公式知,气体密度与摩尔质量成正比,甲烷的摩尔质量是16g/mol、HCl的摩尔质量是36.5g/mol、硫化氢的摩尔质量是34g/mol、氨气的摩尔质量是17g/mol,则这四种气体密度大小顺序是b>c>d>a,故答案为:b>c>d>a.
,根据公式知,气体密度与摩尔质量成正比,甲烷的摩尔质量是16g/mol、HCl的摩尔质量是36.5g/mol、硫化氢的摩尔质量是34g/mol、氨气的摩尔质量是17g/mol,则这四种气体密度大小顺序是b>c>d>a,故答案为:b>c>d>a.

 中考解读考点精练系列答案
中考解读考点精练系列答案【题目】某研究小组探究SO2和Fe(NO3)3溶液的反应。请回答:
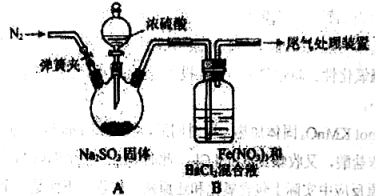
(1)A中滴加浓硫酸之前应进行的操作是打开弹簧夹,通入一段时间N2,再关闭弹簧夹,目的是 。
(2)装置B中产生了白色沉淀,其成分是 。
已知SO2不与BaCl2溶液反应,该研究小组对产生白色沉淀的原因进行了假设:
假设1:SO2与Fe3+反应;
假设2:在酸性条件下SO2与NO3-反应;
假设3: 。
【设计方案、验证假设】
(3)某同学设计实验验证假设2,请帮他完成下表中内容。
实验步骤 | 预期的现象和结论 |
①测定B中实验所用混合溶液的__________ ②配制具有相同 的稀硝酸与BaCl2的混合液并通入适当的 ③将SO2通入上述溶液中 | 若出现白色沉淀则假设2成立 若不出现白色沉淀则假设2不成立 |
经验证假设2成立,则验证过程中发生的离子方程式是 。
(提示:NO3-在不同条件下的还原产物较复杂,此条件未见气体产生)
【思考与交流】
若假设1、假设2都成立,你是否同意假设3,并简述理由 。


