题目内容
【题目】碳、氮、硫、硒等元素的单质及其化合物有重要的科学研究价值。回答下 列问题:
(1)氰[化学式(CN)2]、硫氰[化学式(SCN)2]等与卤素单质性质相似,又称类卤素。(CN)2 中π键和σ键的数目之比为__________。沸点:(CN)2__________ (SCN)2(填“大于”、“等于”或“小于”),理由是__________。
(2)无机含氧酸的通式可写成(HO)mROn,如果成酸元素 R 相同,则 n 值越大,R 的正电性越高,在水中越容易电离出 H+。酸性强弱:HNO2____________HNO3(填“大于”、“等于”或“小于”);NO2-中氮原子的杂化方式为___________。
(3)一种硒单质晶体的晶胞为六方晶胞,原子排列为无限螺旋链,分布在六方晶格上,同一条链内原子作用很强,相邻链之间原子作用较弱,其螺旋链状图、晶 体结构图和晶体结构俯视图如下所示。

已知正六棱柱的边长为 a cm,高为 b cm,NA 表示阿伏加德罗常数,则该晶体的密度为__________g·cm-3(用含 NA、a、b 的式子表示)。
【答案】4:3 小于 (CN)2相对分子质量小于(SCN)2,范德华力较小,则沸点较低 小于 sp2杂化 ![]()
【解析】
(1)(CN)2的结构式为![]() ,单键是σ键,三键中有1个σ键和2个π键,以此分析;分子晶体相对分子质量越大,范德华力越大,沸点越高;
,单键是σ键,三键中有1个σ键和2个π键,以此分析;分子晶体相对分子质量越大,范德华力越大,沸点越高;
(2)HNO2可变形为:HONO,HNO3可变形为:HONO2,再根据题意分析;利用价层电子对互斥理论来分析判断NO2-中氮原子的杂化方式;
(3)利用均摊法计算晶胞中Se原子,注意顶点原子为6个晶胞共用;根据![]() 计算。
计算。
(1)(CN)2的结构式为![]() ,单键是σ键,三键中有1个σ键和2个π键,(CN)2 中π键和σ键的数目之比为4:3;(CN)2与(SCN)2均为分子晶体,且分子间不存在氢键,(CN)2相对分子质量小于(SCN)2,范德华力较小,则沸点较低,故答案为:4:3;小于;(CN)2相对分子质量小于(SCN)2,范德华力较小,则沸点较低;
,单键是σ键,三键中有1个σ键和2个π键,(CN)2 中π键和σ键的数目之比为4:3;(CN)2与(SCN)2均为分子晶体,且分子间不存在氢键,(CN)2相对分子质量小于(SCN)2,范德华力较小,则沸点较低,故答案为:4:3;小于;(CN)2相对分子质量小于(SCN)2,范德华力较小,则沸点较低;
(2)HNO2可变形为:HONO,HNO3可变形为:HONO2,则硝酸中n=2大于亚硝酸中n=1,酸性HNO2小于HNO3;NO2-中氮原子价层电子对数为![]() ,则NO2-中氮原子的杂化方式为sp2杂化,故答案为:小于;sp2杂化;
,则NO2-中氮原子的杂化方式为sp2杂化,故答案为:小于;sp2杂化;
(3)Se原子间形成正六棱柱,位于面心与顶点,从晶胞的俯视图可知晶胞中Se原子数目为![]() ,晶胞质量为
,晶胞质量为![]() ,晶胞的体积
,晶胞的体积![]() ,密度
,密度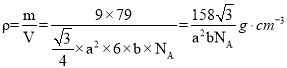 ,故答案为:
,故答案为:![]() 。
。

 名校课堂系列答案
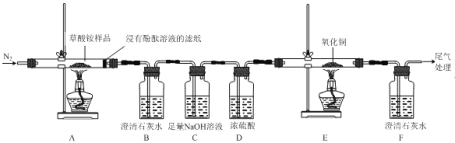
名校课堂系列答案【题目】草酸是一种常用的还原剂,某校高三化学小组探究草酸被氧化的速率问题。
实验Ⅰ | 试剂 | 混合后 溶液pH | 现象 (1h后溶液) | ||
试管 | 滴管 | ||||
| a | 4mL0.01mol·L1 KMnO4溶液,几滴浓H2SO4 | 2mL0.3mol·L1H2C2O4 溶液 | 2 | 褪为无色 |
b | 4mL0.01mol·L1KMnO4溶液,几滴浓NaOH | 7 | 无明显变化 | ||
c | 4mL0.01mol·L1 K2Cr2O7溶液,几滴浓H2SO4 | 2 | 无明显变化 | ||
d | 4mL0.01mol·L1 K2Cr2O7溶液,几滴浓NaOH | 7 | 无明显变化 | ||
(1)H2C2O4是二元弱酸,写出H2C2O4溶于水的电离方程式:_____________。
(2)实验I试管a中KMnO4最终被还原为Mn2+,该反应的离子方程式为:________。
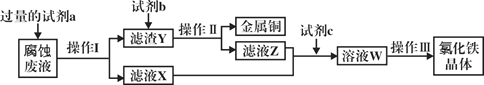
(3)瑛瑛和超超查阅资料,实验I试管c中H2C2O4与K2Cr2O7溶液反应需数月时间才能完成,但加入MnO2可促进H2C2O4与K2Cr2O7的反应。依据此资料,吉吉和昊昊设计如下实验证实了这一点。
实验III | 实验IV | ||
实验操作 |
|
|
|
实验现象 | 6 min后固体完全溶解,溶液橙色变浅,温度不变 | 6 min后固体未溶解,溶液颜色无明显变化 | 6 min后固体未溶解,溶液颜色无明显变化 |
实验IV的目的是:_______________________。
(4)睿睿和萌萌对实验II继续进行探究,发现溶液中Cr2O72- 浓度变化如图:

臧臧和蔡蔡认为此变化是通过两个过程实现的。
过程i.MnO2与H2C2O4反应生成了Mn2+。
过程ii.__________________________________。
①查阅资料:溶液中Mn2+能被PbO2氧化为MnO4-。针对过程i,可采用如下方法证实:将0.0001molMnO2加入到6mL____________中,固体完全溶解;从中取出少量溶液,加入过量PbO2固体,充分反应后静置,观察到_______________。
②波波和姝姝设计实验方案证实了过程ii成立,她们的实验方案是________。
(5)综合以上实验可知,草酸发生氧化反应的速率与__________________有关。