题目内容
【题目】在一定温度下的定容密闭容器中,当下列物理量不再改变时,不能表明反应A(s)+2B(g)![]() C(g)+D(g)已达平衡的是
C(g)+D(g)已达平衡的是
A.混合气体的压强B.混合气体的密度
C.混合气体的相对分子质量D.C的物质的量
【答案】A
【解析】
在一定条件下,当可逆反应的正反应速率和逆反应速率相等时(但不为0),反应体系中各种物质的浓度或含量不再发生变化的状态,称为化学平衡状态,据此解答。
A.根据方程式可知,反应前后气态的体积是不变的,因此压强也是不变的,A不能说明;
B.密度是混合气的质量和容器容积的比值,在反应过程中容积始终是不变的,但气体的质量是变化的,所以B能说明;
C.混合气的平均相对分子质量是混合气的质量和混合气的总的物质的量的比值,物质的量始终不变,但质量是变化的,所以选项C可以说明。
D.C的物质的量不再发生变化,说明正逆反应速率相等,反应达到平衡状态,所以选项D能说明;
答案选A。

【题目】我国《食品添加剂使用卫生标准》中规定葡萄酒中SO2最大使用量为0.25g·L-1。某兴趣小组用图1装置(夹持装置略)收集某葡萄酒中的SO2,并对其含量进行测定。
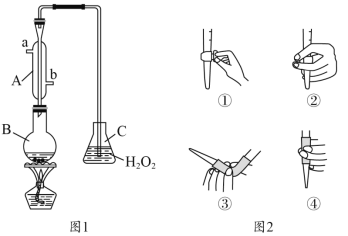
(1)仪器B的名称是__________,冷却水的进口为________。(填“a”或“b”)
(2)B中加入300.00mL葡萄酒和适量硫酸,加热使SO2全部逸出并与C中H2O2完全反应,其化学方程式为______________________________________________。
(3)除去C中过量的H2O2,然后用0.1000mol·L-1NaOH标准溶液进行滴定,滴定前排气泡时,应选择图2中的________;若选择酚酞为指示剂,则滴定终点的现象为_____________________;
(4)经3次平行实验,消耗NaOH溶液体积如下:
序号 | 滴定前读数 | 滴定后读数 |
1 | 0.00 | 20.01 |
2 | 1.00 | 20.99 |
3 | 0.00 | 21.10 |
该葡萄酒中SO2含量为______________g·L-1(保留两位小数)。
【题目】氯气是一种重要的化工原料。
(1)氯气和石灰乳反应可以制得漂白粉,当漂白粉暴露在空气中因吸收了空气中的CO2和H2O而可能部分变质,写出验证漂白粉已部分变质的实验方法:________。
(2)氯水中含有多种成分,因而具有多种性质,根据新制氯水分别与如图四种物质发生的反应填空,a、b、c、d中重合部分代表物质间反应,且氯水足量。
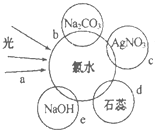
c过程的离子方程式为_______。
e过程中氧化还原反应的化学方程式为________。
d过程所观察到的现象为_______。
b过程证明了氯水中存在_________(填字母)微粒。
A Cl2 B Cl- C HClO DH+
(3)根据下表表弱酸的电离常数,写出二种可以增加饱和氯水中的次氯酸的浓度的钠盐_______。说明选择的理由或条件:_________。
某些弱酸的电离常数(298K) | ||
多元弱酸 | K1 | K2 |
HClO | 2.95×10-8 | |
CH3COOH | 1.76×10-5 | |
H2SO3 | 1.54×10-2 | 1.02×10-17 |
H2CO3 | 4.30×10-7 | 5.61×10-11 |