题目内容
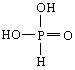
亚磷酸(H3PO3)是一种无色晶体,易溶于水,有大蒜气味和强吸湿性。(1)在亚磷酸溶液中加入过量的NaOH溶液,只生成Na2HPO3和NaH2PO3两种盐,这一实验事实说明亚磷酸的结构是________。
(2)亚磷酸在空气中可逐渐氧化为磷酸,当在碘水中加入亚磷酸溶液并振荡后,碘水的棕黄色褪去,溶液的pH降低;再滴入AgNO3溶液有黄色沉淀析出。写出亚磷酸与碘水反应以及反应后滴入AgNO3溶液生成黄色沉淀的化学方程式________。
(3)在盛有亚磷酸溶液的试管中滴入AgNO3溶液时,有黑色的细小银粒析出,同时在试管口有棕色气体生成。这个反应的化学方程式是:________、________。
解析:
(1)
(2)H3PO3+I2+H2O═H3PO4+2HI HI+AgNO3══AgI↓+HNO3 (3)2H3PO3+AgNO3══Ag↓+NO↑+2H3PO4,2NO+O2═2NO2
|
提示:
| 提示:本题属无机信息给予题,能否准确地抓住有用信息进行合理的分析、推理是解决此类问题的关键。
根据(1)中信息:H3PO3与NaOH反应只生成两种盐,证明H3PO3应为二元酸,有两个氢原子直接与氧原子相连(只有这样的氢原子才能在水溶液中电离出来),于是写出磷酸的结构式。 根据(2)中亚磷酸与碘水反应的实验现象,可证明亚磷酸具有还原性,而I2若被还原,在酸性溶液中,则只能生成HI,进一步可通过生成物与AgNO3反应的现象证实这一结论。 (因Ag3PO4不能在酸性溶液中存在,故生成的黄色沉淀一定是碘化银)。
|

 寒假乐园北京教育出版社系列答案
寒假乐园北京教育出版社系列答案| 名称 | 次氯酸 | 磷酸 | 硫酸 | 高氯酸 |
| 结构式 | Cl-OH | 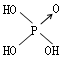 |
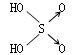 |
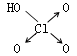 |
| 非羟基氧原子数 | 0 | 1 | 2 | 3 |
| 酸性 | 弱酸 | 中强酸 | 强酸 | 最强酸 |
(2)H3PO3和H3AsO3与过量的NaOH溶液反应的化学方程式分别是:①
(3)在H3PO3和H3AsO3中分别加入浓盐酸,化学方程式为:
请按要求回答下列问题:
(4)指出下面物质分子或离子的空间构型:PO43-
(5)有两种活性反应中间体微粒,它们的微粒中均含有1个碳原子和3个氢原子.根据下面给出的这两种微粒的球棍模型,写出相应的化学式:
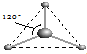
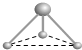
(6)按要求写出第二周期非金属元素构成的中性分子的化学式:平面形分子
(8分)判断含氧酸强弱的一条经验规律:含氧酸分子结构中含非羟基氧原子数越多,该含氧酸的酸性越强。几种实例如下表所示。
|
|
次氯酸 |
磷酸 |
硫酸 |
高氯酸 |
|
含氧酸 |
|
|
|
|
|
非羟基 氧原子数 |
0 |
1 |
2 |
3 |
|
酸性 |
弱酸 |
中强酸 |
强酸 |
最强酸 |
(1)亚磷酸(H3PO3)和亚砷酸(H3AsO3)的分子式相似,但它们的酸性差别很大。亚磷酸是中强酸,亚砷酸既有弱酸性又有弱碱性,由此可推出它们的结构式分别为:
亚磷酸_____________________________________________,
亚砷酸_______________________________________。
(2)分别写出亚磷酸和亚砷酸与过量的NaOH溶液反应的化学方程式。
亚磷酸:___________________________________________,
亚砷酸:________________________________________________。
(3)在亚磷酸和亚砷酸中分别加入浓盐酸,分析反应情况,可以反应的用化学方程式表示。
亚磷酸:__________________________________________________
亚砷酸_________________________________________________。





