题目内容
(13分)将8.6 g的铜银合金完全溶于浓HNO3,若反应中硝酸的还原产物只有NO2和N2O4,且它们的体积均为1.12 L(标准状况),则该铜银合金中铜和银的质量分别为多少?
3.2 g 5.4 g
 ="0.05" mol
="0.05" mol设合金中Cu为x mol,Ag为y mol。则
 解得
解得
所以m(Cu)="64" g·mol-1×0.05 mol="3.2" g
m(Ag)="8.6" g-3.2 g="5.4" g

练习册系列答案
 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案
相关题目


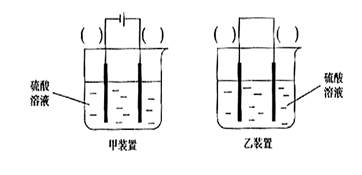
 2Cu+SO2
2Cu+SO2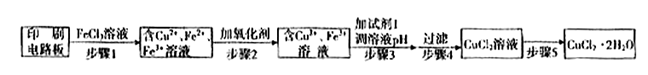 ①证明步骤I所加FeCl3溶液过量的方法是 。
①证明步骤I所加FeCl3溶液过量的方法是 。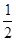 O2(g)==H2O(l) △H3=-286kJ/mol
O2(g)==H2O(l) △H3=-286kJ/mol