题目内容
根据下列各步实验操作及产生的现象,推断下列物质:

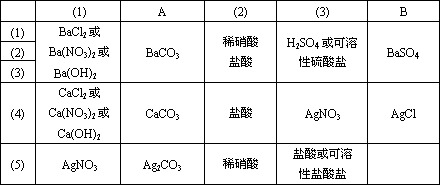
(1)________ (2)________ (3)________
A________ B________
答案:
解析:
解析:
|
答案:可能有以下几组:
解析:在学过的知识中,题中A物质属难溶性碳酸盐,B物质是BaSO4或AgCl,由于题目对A、B及(1)、(2)、(3)等物质没有作出任何限定,这样给回答的范围留下了很宽广的想像空间,也使结论具有了多样性. 方法技巧:本题虽给出了一定的已知条件,但有些条件不够具体,这样导致了符合条件的结论不惟一,需对条件进行优化组合,在探索条件变化中得出结论.此类试题重要的还不只是答案本身的多样性,而在于寻求解答过程中,学生通过比较各种答案的途径以实现认知结构的重建. |

练习册系列答案
相关题目
 如图为实验室某浓盐酸试剂瓶标签上的有关数据,试根据标签上的有关数据回答下列问题:
如图为实验室某浓盐酸试剂瓶标签上的有关数据,试根据标签上的有关数据回答下列问题: