题目内容
下列离子方程式中,正确的是
[ ]
A.把金属铁放入稀硫酸中

B.碳酸钡和稀硫酸反应

C.澄清石灰水跟盐酸反应

D.向硫酸铜溶液中加入适量氢氧化钡溶液

E.向氯化亚铁溶液中通入氯气生成氯化铁溶液

解析:
|
选项A错在不符合反应的实际情况,因为铁与稀硫酸反应生成硫酸亚铁和氢气,而不是硫酸铁和氢气.正确的离子方程式为:
选项B的错误是忽略了生成物硫酸钡是不溶性物质.碳酸钡和稀硫酸反应的离子方程式应是:
选项C正确.澄清石灰水,微溶物 选项D的错误是只注意书写
选项E虽然表现了
总之,检查某反应的离子方程式是否正确时;一要检查反应物、生成物是否正确;二是检查易溶、易电离的物质是否写成离子形式,难溶、难电离的物质和气体,单质、氧化物是否写成化学式;三是检查是否已遵守两个守恒,即质量守恒(等号两端同种原子个数要相等)和电荷守恒(符号两端所带电量要相等);四要检查反应条件,生成物中的气体,沉淀是否已标“↓”、“↑”. |

铁及其化合物在生产、生活中有广泛应用。请回答下列问题:
(1)水热法制备Fe3O4纳米颗粒的反应是:3Fe2++2S2O32-+O2+xOH-→Fe3O4↓+S4O32-+2H2O
①上述离子方程式中x=________;
②每生成1 mol Fe3O4,反应转移的电子为________mol;
(2)某高效净水剂可由Fe(OH)SO4聚合得到。工业上以FeSO4、NaNO2和稀硫酸为原料来制备Fe(OH)SO4,反应中有NO生成,化学方程式为 。
高炉炼铁过程中发生的主要反应为: Fe2O3(s)+ CO(g)
Fe2O3(s)+ CO(g)

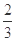 Fe(s)+CO2(g)+Q
Fe(s)+CO2(g)+Q
已知该反应在不同温度下的平衡常数如下:
|
温度/℃ |
1000 |
1115 |
1300 |
|
平衡常数 |
4.0 |
3.7 |
3.5 |
(3)该反应的平衡常数表达式K=_ ;Q 0(填“>”、“<”或“=”);
(4)欲提高上述反应中CO的平衡转化率,可采取的措施是 ;
A.提高反应温度 B.移出部分CO2
C.加入合适的催化剂 D.减小容器的容积
(5)在一个容积为10L的密闭容器中,1000℃时加入Fe、Fe2O3、CO、CO2各1.0 mol,此时v正 v逆(填“等于”、“大于”或“小于”)。经过l0 min,在1000℃达到平衡,则该时间范围内反应的平均反应速率v (CO2)= 。


 已完全电离,跟盐酸反应的实质是
已完全电离,跟盐酸反应的实质是 的反应.
的反应. 反应的离子方程式,而忽略了
反应的离子方程式,而忽略了 也反应,犯了“只顾其一,不顾其二”的过失.应写成:
也反应,犯了“只顾其一,不顾其二”的过失.应写成:
 的反应实质,两边各元素的原子个数也相等,但两边的电荷不守恒;得失电子个数不相等.所以不正确.正确的离子方程式应为:
的反应实质,两边各元素的原子个数也相等,但两边的电荷不守恒;得失电子个数不相等.所以不正确.正确的离子方程式应为:



 式 。
式 。