题目内容
(1)现有反应:CO(g)+H2O(g)?CO2(g)+H2(g)+Q.在850℃时,K=1.
①若升高温度到950℃时,达到平衡时K 1(填“大于”“小于”或“等于”).
②850℃时,若向一容积可变的密闭容器中同时充入1.0mol CO,3.0mol H2O,1.0mol CO2和x mol
H2,则:当x=5.0时,上述平衡向 (填“正反应”或“逆反应”)方向移动.
③在850℃时,若设x=5.0和x=6.0,其他物质的投料不变,当上述反应达到平衡后,测得
H2的体积分数分别为a%、b%,则a b(填“大于”“小于”或“等于”).
(2)在100℃时,将0.100mol的四氧化二氮气体充入1L恒容抽空的密闭容器中,隔一定时间对该容器内的物质浓度进行分析得到下表数据:
①从表中数据分析:c1 c2 (填“>”、“<”或“=”).
②在上述条件下,从反应开始至达到化学平衡时,四氧化二氮的平均反应速率为 mol/(L?s).
③达平衡后下列条件的改变可使NO2气体浓度增大的是 .
A.增大容器的容积 B.再充入一定量的N2O4C.分离出一定量的NO2 D.再充入一定量的He
④若起始时充入NO2气体0.080mol,则达到平衡时NO2气体的转化率为 .
①若升高温度到950℃时,达到平衡时K
②850℃时,若向一容积可变的密闭容器中同时充入1.0mol CO,3.0mol H2O,1.0mol CO2和x mol
H2,则:当x=5.0时,上述平衡向
③在850℃时,若设x=5.0和x=6.0,其他物质的投料不变,当上述反应达到平衡后,测得
H2的体积分数分别为a%、b%,则a
(2)在100℃时,将0.100mol的四氧化二氮气体充入1L恒容抽空的密闭容器中,隔一定时间对该容器内的物质浓度进行分析得到下表数据:
| 时间(s) | 0 | 20 | 40 | 60 | 80 |
| c(N2O4)/mol/L | 0.100 | c1 | 0.050 | c3 | c4 |
| c(NO2)/mol/L | 0.000 | 0.060 | c2 | 0.120 | 0.120 |
②在上述条件下,从反应开始至达到化学平衡时,四氧化二氮的平均反应速率为
③达平衡后下列条件的改变可使NO2气体浓度增大的是
A.增大容器的容积 B.再充入一定量的N2O4C.分离出一定量的NO2 D.再充入一定量的He
④若起始时充入NO2气体0.080mol,则达到平衡时NO2气体的转化率为
考点:化学平衡的计算,化学平衡的影响因素
专题:
分析:(1)①对于放热反应,升高温度,平衡常数减小;
②反应混合物各物质的量系数相同都为1,利用物质的量代替浓度,计算浓度商Qc,根据浓度商Qc与平衡常数k的关系判断.Qc>k平衡向逆反应进行,Qc=k反应处于平衡状态,Qc<k平衡向正反应进行;
③增大一种生产物(氢气)的体积分数,平衡向逆反应方向移动,平衡移动的结果是降低这种增大的幅度,故平衡后氢气的体积分数还是大于原来的;
(2)①根据方程式及表中数据计算c2、c1;
②由表可知,60s时反应达平衡,根据方程式计算△c(N2O4),依据化学反应速率V=
计算;
③依据化学平衡原理分析改变条件提高NO2转化率的选项;
④依据平衡浓度计算平衡常数,结合化学平衡三段式列式计算,转化率=
×100%.
②反应混合物各物质的量系数相同都为1,利用物质的量代替浓度,计算浓度商Qc,根据浓度商Qc与平衡常数k的关系判断.Qc>k平衡向逆反应进行,Qc=k反应处于平衡状态,Qc<k平衡向正反应进行;
③增大一种生产物(氢气)的体积分数,平衡向逆反应方向移动,平衡移动的结果是降低这种增大的幅度,故平衡后氢气的体积分数还是大于原来的;
(2)①根据方程式及表中数据计算c2、c1;
②由表可知,60s时反应达平衡,根据方程式计算△c(N2O4),依据化学反应速率V=
| △c |
| △t |
③依据化学平衡原理分析改变条件提高NO2转化率的选项;
④依据平衡浓度计算平衡常数,结合化学平衡三段式列式计算,转化率=
| 消耗量 |
| 起始量 |
解答:
解:(1)①该反应是一个放热反应,升高温度,平衡常数减小,所以K<1,故答案为:小于;
②x=5时,此时的浓度商为:Qc=
=1.67>1,浓度商大于平衡常数,则平衡向逆反应方向移动,故答案为:逆反应;
③加入6mol氢气所到达的平衡,可以等效为在加入5mol氢气到达平衡后再加入1mol氢气,增大一种生产物(氢气)的体积分数,平衡向逆反应方向移动,平衡移动的结果是降低这种增大的幅度,但平衡后氢气的体积分数还是大于原来的,故得H2的体积分数分别为:a%<b%,即:a小于b,
故答案为:小于;
(2)①N2O4(g)?2NO2(g)20s时c(NO2)=0.060mol/L,
N2O4 ?2NO2,
浓度变化 0.030mol 0.060mol/L,
则:c1=0.10mol/L-0.03mol/L=0.070mol/L,
由表可知,40s时,c(N2O4)=0.050mol/L,
N2O4 ?2NO2
浓度变化:(0.1-0.05)mol/L 0.10mol/L
则:c2=0.10mol/L,
所以:c2>c1;
故答案为:<;
②由表可知,60s时反应达平衡,c(NO2)=0.120mol/L,
N2O4 ?2NO2,
浓度变化:0.06mol/L 0.120mol/L
V(N2O4)=
=0.001mol/(L?s),
故答案为:0.001;
③N2O4=2 NO2 反应是气体体积减小的放热反应,依据化学平衡原理分析选项,增大二氧化氮浓度的条件;
A.增大容器体积,各组分浓度均减小,故A错误;
B.再充入四氧化二氮,平衡正向移动,二氧化氮浓度增大,故B正确;
C.减小NO2的浓度,平衡虽正向进行,但二氧化氮的浓度减小,故C错误;
D.再充入一定量的He,总压增大,气体分压不变,平衡不变,二氧化氮浓度不变,故D错误;
故答案为:B;
④依据平衡浓度计算平衡常数,结合化学平衡三段式列式计算;
N2O4?2NO2,
起始量(mol/L) 0.10 0
变化量(mol/L) 0.06 0.12
平衡量(mol/L) 0.04 0.12
该温度下的平衡常数为:K=
=0.36
若起始时充入N02气体0.080mol,设消耗二氧化氮物质的量浓度为x,反应2NO2=N2O4的平衡常数为K=
,
2 NO2=N2O4
起始量(mol/L) 0.0800 0
变化量(mol/L) x 0.5x
平衡量(mol/L) 0.080-x 0.5x
平衡常数为:K=
=
,
解得:x=0.020mol/L,
则达到平衡时N02气体的转化率为:
×100%=25%,
故答案为:25%.
②x=5时,此时的浓度商为:Qc=
| 1×5 |
| 1×3 |
③加入6mol氢气所到达的平衡,可以等效为在加入5mol氢气到达平衡后再加入1mol氢气,增大一种生产物(氢气)的体积分数,平衡向逆反应方向移动,平衡移动的结果是降低这种增大的幅度,但平衡后氢气的体积分数还是大于原来的,故得H2的体积分数分别为:a%<b%,即:a小于b,
故答案为:小于;
(2)①N2O4(g)?2NO2(g)20s时c(NO2)=0.060mol/L,
N2O4 ?2NO2,
浓度变化 0.030mol 0.060mol/L,
则:c1=0.10mol/L-0.03mol/L=0.070mol/L,
由表可知,40s时,c(N2O4)=0.050mol/L,
N2O4 ?2NO2
浓度变化:(0.1-0.05)mol/L 0.10mol/L
则:c2=0.10mol/L,
所以:c2>c1;
故答案为:<;
②由表可知,60s时反应达平衡,c(NO2)=0.120mol/L,
N2O4 ?2NO2,
浓度变化:0.06mol/L 0.120mol/L
V(N2O4)=
| 0.060mol/L |
| 60s |
故答案为:0.001;
③N2O4=2 NO2 反应是气体体积减小的放热反应,依据化学平衡原理分析选项,增大二氧化氮浓度的条件;
A.增大容器体积,各组分浓度均减小,故A错误;
B.再充入四氧化二氮,平衡正向移动,二氧化氮浓度增大,故B正确;
C.减小NO2的浓度,平衡虽正向进行,但二氧化氮的浓度减小,故C错误;
D.再充入一定量的He,总压增大,气体分压不变,平衡不变,二氧化氮浓度不变,故D错误;
故答案为:B;
④依据平衡浓度计算平衡常数,结合化学平衡三段式列式计算;
N2O4?2NO2,
起始量(mol/L) 0.10 0
变化量(mol/L) 0.06 0.12
平衡量(mol/L) 0.04 0.12
该温度下的平衡常数为:K=
| 0.122 |
| 0.04 |
若起始时充入N02气体0.080mol,设消耗二氧化氮物质的量浓度为x,反应2NO2=N2O4的平衡常数为K=
| 1 |
| 0.36 |
2 NO2=N2O4
起始量(mol/L) 0.0800 0
变化量(mol/L) x 0.5x
平衡量(mol/L) 0.080-x 0.5x
平衡常数为:K=
| 0.5x |
| (0.080-x)2 |
| 1 |
| 0.36 |
解得:x=0.020mol/L,
则达到平衡时N02气体的转化率为:
| 0.020mol/L |
| 0.080mol/L |
故答案为:25%.
点评:本题考查了化学平衡的计算,题目难度较大,试题知识点较多、综合性较强,充分考查了学生的分析、理解能力及化学计算能力,注意掌握化学平衡的影响因素、平衡常数的概念及表达式,明确化学反应速率的计算方法.

练习册系列答案
相关题目
下列有关化学用语使用正确的是( )
A、氧的原子结构示意图: | ||
B、质量数为35的氯原子:
| ||
C、CH4分子的比例模型: | ||
D、次氯酸分子的电子式: |
往FeCl3和BaCl2的混合液中通入足量SO2,最终可得到( )
| A、无沉淀 |
| B、有S沉淀 |
| C、沉淀为BaSO3 |
| D、沉淀为BaSO4 |
下列说法正确的是( )
| A、肾功能衰竭等疾病引起的血液中毒,可利用血液透析进行治疗 |
| B、工艺师利用盐酸蚀刻石英制作艺术品 |
| C、除去CO2中少量的SO2,使混合气体通过盛饱和碳酸钠溶液的洗气瓶 |
| D、我国自主研发的“龙芯1号”CPU芯片与光导纤维是同种材料 |
1mol 下列物质与足量的银氨溶液作用,可还原出4mol Ag 的是( )
| A、丙醛 | B、乙二醛 | C、甲醛 | D、乙醛 |
今有组成为CH4O和C3H8O的混合物,在用浓H2SO4作用下进行脱水反应,可能生成的其它有机物的种类为( )
| A、3种 | B、4种 | C、7种 | D、8种 |
有1体积的乙烯和乙炔的混合气体,恰好能跟相同条件下的1.6体积的H2完全反应生成乙烷,则混合气体中,乙烯和乙炔的物质的量之比是( )
| A、1:4 | B、3:7 |
| C、2:3 | D、2:1 |
邻羟基苯甲酸,俗名水杨酸,结构简式为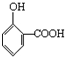 ,它与物质A的溶液反应生成化学式为C7H5O3Na的钠盐,A可以是下列中的( )
,它与物质A的溶液反应生成化学式为C7H5O3Na的钠盐,A可以是下列中的( )
 ,它与物质A的溶液反应生成化学式为C7H5O3Na的钠盐,A可以是下列中的( )
,它与物质A的溶液反应生成化学式为C7H5O3Na的钠盐,A可以是下列中的( )| A、NaCl |
| B、Na2SO4 |
| C、NaOH |
| D、NaHCO3 |
