题目内容
【题目】在![]() 的密闭容器中,放入镍粉并充入
的密闭容器中,放入镍粉并充入![]() 定量的CO气体,一定条件下发生反应:
定量的CO气体,一定条件下发生反应:![]() ,已知该反应平衡常数与温度的关系如表所示:下列说法正确的是
,已知该反应平衡常数与温度的关系如表所示:下列说法正确的是![]()
![]()
温度 | 25 | 80 | 230 |
平衡常数 |
| 2 |
|
A.上述生成Ni![]()
![]() 的反应为吸热反应
的反应为吸热反应
B.![]() 时反应Ni
时反应Ni![]()
![]() 的平衡常数为
的平衡常数为![]()
C.在![]() 时,测得某时刻,
时,测得某时刻,![]() 、CO浓度均
、CO浓度均![]()
![]() ,则此时
,则此时![]()
D.![]() 达到平衡时,测得
达到平衡时,测得![]() 3mol,则
3mol,则![]() 的平衡浓度为2
的平衡浓度为2![]()
【答案】D
【解析】
A.由表中数据可知,温度越高K越小,则升高温度平衡逆向移动,正反应为放热反应,故A错误;
B.两反应互为逆反应时,K互为倒数关系,![]() 时反应
时反应![]() 的平衡常数为
的平衡常数为![]() ,故B错误;
,故B错误;
C.![]() 时
时![]() ,某时刻,
,某时刻,![]() 、CO浓度均
、CO浓度均![]() ,
,![]() ,平衡逆向移动,此时
,平衡逆向移动,此时![]() ,故C错误;
,故C错误;
D.设![]() 的平衡浓度为x,平衡时,测得
的平衡浓度为x,平衡时,测得![]() ,
, ,解得
,解得![]() ,故D正确;
,故D正确;
故答案选D。

 小学课时作业全通练案系列答案
小学课时作业全通练案系列答案【题目】![]() 与
与![]() 催化重整反应为
催化重整反应为![]()
![]() 。现向
。现向![]() 恒容密闭容器中充入
恒容密闭容器中充入![]() 和
和![]() 进行催化重整反应,不同温度下平衡体系中
进行催化重整反应,不同温度下平衡体系中![]() 和CO的体积分数
和CO的体积分数![]() 随温度变化如下表所示:
随温度变化如下表所示:
体积分数 温度 |
|
|
| a | a |
| c | b |
测得:![]() ,下列说法正确的是
,下列说法正确的是![]()
![]()
A.![]() 大于
大于![]()
B.![]() 时该反应的平衡常数为
时该反应的平衡常数为![]()
C.![]() 时向
时向![]() 恒容密闭容器中充入
恒容密闭容器中充入![]() 和
和![]() 进行催化重整反应,达到平衡时,
进行催化重整反应,达到平衡时,![]() 为
为![]()
D.![]() 时向
时向![]() 恒容密闭容器中充入等物质的量
恒容密闭容器中充入等物质的量![]() 、
、![]() 、CO、
、CO、![]() 进行催化重整反应,此时反应可能正向移动
进行催化重整反应,此时反应可能正向移动
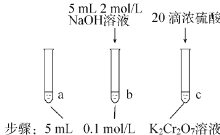
【题目】某同学研究浓度对化学平衡的影响,下列说法正确的是
| 待试管b中颜色不变后与试管a比较,溶液颜色变浅。滴加浓硫酸,试管c温度略有升高,溶液颜色与试管 a 相比,变深。 |
已知:![]() (aq)(橙色) + H2O(l)2
(aq)(橙色) + H2O(l)2![]() (aq) (黄色)+ 2H+(aq) △H=+13.8 kJ/mol
(aq) (黄色)+ 2H+(aq) △H=+13.8 kJ/mol
A.该反应为氧化还原反应
B.待试管 b 中溶液颜色不变的目的是使![]() 完全反应
完全反应
C.试管c中的现象说明影响平衡的主要因素是温度
D.该实验不能证明减小生成物浓度平衡正向移动
【题目】一定温度下,在4个容积均为1 L的恒容容器中分别进行反应(各容器中A都足量)A(s)+B(g)![]() C(g)+D(g) ΔH =+100 kJ·mol-1,某时刻测得部分数据如下表:
C(g)+D(g) ΔH =+100 kJ·mol-1,某时刻测得部分数据如下表:
容器编号 | n(B)/mol | n(C)/mol | n(D)/mol | 反应时间/min | 反应速率 |
Ⅰ | 0.06 | 0.60 | 0.10 | t1 | v(正)=v(逆) |
Ⅱ | 0.12 | 1.20 | 0.20 | t2 | |
Ⅲ | 0.32 | 1.0 | 0 | 0 | |
Ⅳ | 0.12 | 0.30 | v(正)=v(逆) |
下列说法正确的是
A.容器Ⅰ中平均反应速率v(B)=0.04/t1 mol·L-1·min-1
B.t2时容器Ⅱ中v(正)>v(逆)
C.容器Ⅲ
D.容器Ⅳ中c(D)= 0.4 mol·L-1