题目内容
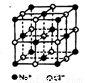
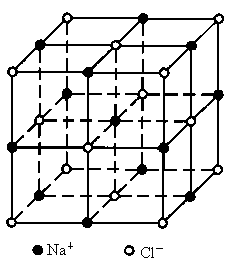
氯化钠晶体具有立方体结构,如图所示,立方体中的圆圈是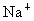 或
或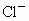 离子所处位置.在该晶体中,每个
离子所处位置.在该晶体中,每个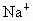 离子周围与它最接近的且距离相等的
离子周围与它最接近的且距离相等的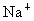 离子的个数共有
离子的个数共有
[ ]
A.6个
B.8个
C.12个
D.16个
答案:C
解析:
解析:
|
解析:此题考查了学生对晶体的微观结构的空间想像能力.我们可以以排布在立方体中心上的  为例来考虑这个问题.从题中给出结构的示意图可以看出:经过立方体的中心 为例来考虑这个问题.从题中给出结构的示意图可以看出:经过立方体的中心 的平面共三个,每个平面的四个顶点上的 的平面共三个,每个平面的四个顶点上的 都是在晶体中与中心 都是在晶体中与中心 最接近且距离相等的,这样的 最接近且距离相等的,这样的 离子共12个. 离子共12个. |

练习册系列答案
相关题目

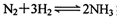 实现储氢和输氢。下列说法正确的是
;
实现储氢和输氢。下列说法正确的是
;