题目内容
如何用密度为 ,质量分数为98%的浓硫酸来配制
,质量分数为98%的浓硫酸来配制 溶液500mL?简述配制过程.
溶液500mL?简述配制过程.
答案:略
解析:
解析:
|
①计算:设需浓 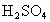 的体积为V.则有: 的体积为V.则有:
解得 V=13.6mL.②量取:用 20mL的量筒小心地量取13.6mL的浓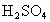 . .
③溶解:向 250mL烧杯中注入约100mL蒸馏水,把量取的浓硫酸慢慢沿烧杯壁注入蒸馏水中,同时不断用玻璃棒搅拌.冷却至室温.④移液:将烧杯中的溶液用玻璃棒小心地引流到 500mL的容量瓶中.用少量蒸馏水洗涤烧杯和玻璃棒2~3次,并将每次洗涤的溶液都用玻璃棒引流到容量瓶中.⑤定容:继续向容量瓶中水至离刻度线 1~2cm,振荡后改用胶头滴管滴加蒸馏水到溶液的凹液面正好与刻度线相切,再将容量瓶塞盖好,反复上下颠倒、摇匀,即得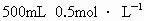 的稀硫酸溶液. 的稀硫酸溶液.
配制过程遵从一定物质的量浓度溶液配制的基本步骤.此题中的溶质源于液体浓硫酸,故先应计算出所需浓 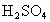 的体积.溶解时要注意只能将浓硫酸缓慢地倒入水中稀释,以防放热发生飞溅,放冷后再转移到容量瓶中. 的体积.溶解时要注意只能将浓硫酸缓慢地倒入水中稀释,以防放热发生飞溅,放冷后再转移到容量瓶中. |

练习册系列答案
相关题目
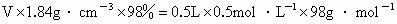
 ,质量分数为98%的浓硫酸来配制
,质量分数为98%的浓硫酸来配制 溶液500mL?简述配制过程.
溶液500mL?简述配制过程. ,质量分数为w%,物质的量浓度为
,质量分数为w%,物质的量浓度为