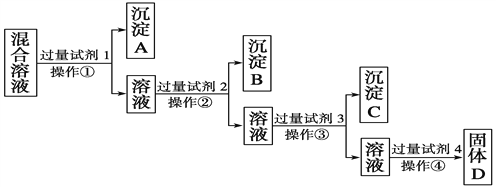
��Ŀ����
����Ŀ������������Ҫ�ɷ���Al2O3 �� ��SiO2��Fe2O3��MgO�����ʣ�����ȡ�����������ֹ���������ͼ��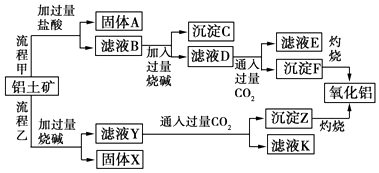
��ش��������⣺
��1��д�����̼����漰�����ӷ���ʽΪ���� ��
��2�������Ҽ����ռ��Al2O3������Ӧ�����ӷ���ʽΪ ��
��3������C����Ҫ�ɷ��� �� ��ȥ����C�IJ����� ��
��4����ҺD�����ʵ���Ҫ�ɷ������ѧʽ����д������ҺD��ͨ�����CO2������Ӧ�����ӷ���ʽ ��
��5���������У�ѡ��CO2���ữ�����ܲ������������CO2 ����ԭ���� ��
���𰸡�
��1��Al2O3+6H+�T2Al3++3H2O,Fe2O3+6H+�T2Fe3++3H2O,MgO+2H+�TMg2++H2O
��2��Al2O3+2OH���T2AlO2��+H2O
��3��Mg��OH��2��Fe��OH��3,����
��4��NaAlO2,AlO2��+CO2+2H2O=Al��OH��3��+HCO3��
��5������,��Ϊ������������Al��OH��3��Ӧ����AlCl3������AlO2��+4H+�TAl3++2H2O��
���������⣺�ɹ������̼�֪����������Ҫ�ɷ���Al2O3����SiO2��Fe2O3��MgO�����ʣ��������������ᷴӦ�ù���AΪ��ҺB�������AΪSiO2����ҺB�����Ȼ������Ȼ������Ȼ�þ�ȣ���Һ�м��������NaOH������֪����CΪ����������������þ����ҺD����ƫ�����ơ��Ȼ��ơ�NaOH����������ҺD��ͨ�����������̼��������������������̼�����ƣ�����FΪAl��OH��3����ҺE�к���NaCl��NaHCO3��
���ݹ��������ҿ�֪���������е�Al2O3��SiO2�ܺ��������Ʒ�Ӧ����֪����XΪFe2O3��MgO�ȣ���ҺYΪ�����ơ�ƫ�����ƣ���Һ��ͨ�����������̼������ZΪAl��OH��3�����ᣬ��ҺK�к���NaHCO3��
��1������������������MgO�ֱ���ᷴӦ�����κ�ˮ�����ӷ���ʽ�ֱ�ΪAl2O3+6H+�T2Al3++3H2O��Fe2O3+6H+�T2Fe3++3H2O��MgO+2H+�TMg2++H2O��
���Դ��ǣ�Al2O3+6H+�T2Al3++3H2O��Fe2O3+6H+�T2Fe3++3H2O��MgO+2H+�TMg2++H2O��
��2��������������������Һ��Ӧ����ƫ�����ƺ�ˮ�����ӷ���ʽΪAl2O3+2OH���T2AlO2��+H2O��
���Դ��ǣ�Al2O3+2OH���T2AlO2��+H2O��
��3������C�ijɷ���Mg��OH��2��Fe��OH��3�����������Թ������Һ���ù��˷��������Գ�ȥ����C���ù��˷�����
���Դ��ǣ�Mg��OH��2��Fe��OH��3�����ˣ�
��4����ҺD������ΪNa AlO2��ƫ�����ƺ���������̼��Ӧ������������������̼�����ƣ����ӷ���ʽΪAlO2��+CO2+2H2O=Al��OH��3��+HCO3����
���Դ��ǣ�NaAlO2�� AlO2��+CO2+2H2O=Al��OH��3��+HCO3����
��5����������������̼����Һ��������ϡ���ᣬ�����Ȼ��������Բ�����ϡ������������̼��
���Դ��ǣ����ܣ���Ϊ������������Al��OH��3��Ӧ����AlCl3������AlO2��+4H+�TAl3++2H2O����

 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�