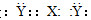题目内容
X、Y、Z、W是原子序数依次增大的四种短周期元素,甲、乙、丙、丁、戊是由其中的两种或三种元素组成的化合物,己是由Z元素形成的单质。已知:甲+乙=丁+己,甲+丙=戊+己; 0.1 mol·L-1丁溶液的pH为13(25 ℃)。下列说法正确的是( )
| A.原子半径:W>Z>Y>X |
| B.Y元素在周期表中的位置为第3周期第ⅣA族 |
| C.1 mol甲与足量的乙完全反应共转移1 mol电子 |
| D.化合物甲中只有离子键 |
C
解析

练习册系列答案
 暑假作业海燕出版社系列答案
暑假作业海燕出版社系列答案
相关题目
某矿石由前20号元素中的4种组成,其化学式为WmYnZpXq。X、Y、Z、W分布在三个周期,原子序数依次增大,W、Y为金属元素,X原子的最外层电子数是次外层电子数的3倍,W单质能与冷水剧烈反应,Y、Z原子的最外层电子数之和与X、W原子的最外层电子数之和相等,Y、Z位于同周期,Z单质是一种良好的半导体。下列说法正确的是( )
| A.气态氢化物的稳定性:X<Z |
| B.含有1 mol Y的氯化物的水溶液中离子总数为4 mol(不考虑水的电离) |
| C.W位于第三周期ⅠA族,其原子半径比其他元素的都大 |
| D.2 mol W单质和1 mol Y单质投入足量的水中会产生2.5 mol气体 |
下列叙述中正确的是( )
| A.以共价键形成的单质中只存在非极性键,以共价键形成的化合物中只存在极性键 |
| B.NaCl和SiC晶体熔化时,克服粒子间作用力的类型相同 |
| C.PCl3和Na2O2中各原子或离子最外层都满足8电子稳定结构 |
| D.24Mg34S晶体中电子总数与中子总数之比为1∶1 |
现有5种短周期元素X、Y、Z、Q、W,原子序数依次增大,在周期表中X原子半径最小;X和W同主族;Y元素原子核外电子总数是其次外层电子数的3倍;Q元素是地壳中含量最高的元素。下列说法不正确的是( )
| A.原子半径:Y<Q<W |
| B.ZX3可使紫色石蕊溶液变蓝 |
| C.X、Z、Q 3种元素可组成离子化合物或共价化合物 |
| D.X2Q2、Y2X6 2种分子中含有的电子数、化学键种类都相同 |
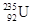 是重要的核工业原料,但在自然界的丰度很低,
是重要的核工业原料,但在自然界的丰度很低,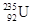 的浓缩一直为国际社会关注。下列有关
的浓缩一直为国际社会关注。下列有关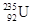 说法正确的是( )
说法正确的是( )
A.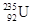 原子核中含有92个中子 原子核中含有92个中子 | B.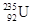 原子核外有143个电子 原子核外有143个电子 |
C.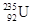 与 与 是同一种核素 是同一种核素 | D.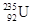 与 与 互为同位素 互为同位素 |
短周期元素X、Y、Z、W、Q在元素周期表的位置如表所示,其中X元素的原子内层电子数是最外层电子数的一半,则下列说法中正确的是( )
| X | | Y | |
| Z | | W | Q |
A.钠与W可能形成Na2W2化合物
B.由Z与Y组成的物质在熔融时能导电
C.W得电子能力比Q强
D.X有多种同素异形体,而Y不存在同素异形体