题目内容
如图所示,反应:X(g)+3Y(g) 2Z(g);△H<0,在不同温度、不同压强(p1>p2)下,达到平衡时,混合气体中Z的百分含量随温度变化的曲线应为
2Z(g);△H<0,在不同温度、不同压强(p1>p2)下,达到平衡时,混合气体中Z的百分含量随温度变化的曲线应为
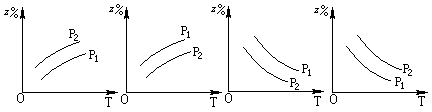
A. B. C. D.
 2Z(g);△H<0,在不同温度、不同压强(p1>p2)下,达到平衡时,混合气体中Z的百分含量随温度变化的曲线应为
2Z(g);△H<0,在不同温度、不同压强(p1>p2)下,达到平衡时,混合气体中Z的百分含量随温度变化的曲线应为
A. B. C. D.
C
试题分析:根据反应可知,该反应为放热反应,且反应物计量数之和大于生成物计量数。增大压强,Z百分含量应增大,升高温度Z百分含量降低。选项中C图像符合,故选择C选项。

练习册系列答案
 一本好题口算题卡系列答案
一本好题口算题卡系列答案
相关题目
 2NO2(g)体系中,n(NO)随时间的变化如表:
2NO2(g)体系中,n(NO)随时间的变化如表:
 H2(g)+CO2(g)平衡常数随温度的变化如下表:
H2(g)+CO2(g)平衡常数随温度的变化如下表:
 CH3OH(g) + H2O(g) ΔH=-49.0 kJ?mol-1。一定条件下,向体积为2 L的密闭容器中充入2 mol CO2和6 mol H2,测得CO2和CH3OH(g)的浓度随时间变化曲线如图所示。下列叙述中,正确的是
CH3OH(g) + H2O(g) ΔH=-49.0 kJ?mol-1。一定条件下,向体积为2 L的密闭容器中充入2 mol CO2和6 mol H2,测得CO2和CH3OH(g)的浓度随时间变化曲线如图所示。下列叙述中,正确的是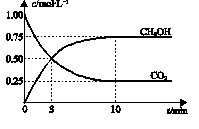
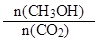 增大
增大 2NH3(g) ΔH=-92.4 kJ/mol。在500 ℃、20 MPa时,将N2、H2置于一个固定容积的密闭容器中发生反应,反应过程中各种物质的量浓度变化如图所示,回答下列问题:
2NH3(g) ΔH=-92.4 kJ/mol。在500 ℃、20 MPa时,将N2、H2置于一个固定容积的密闭容器中发生反应,反应过程中各种物质的量浓度变化如图所示,回答下列问题:

 N2O4(g) △H <0。在恒温条件下将一定量NO2和N2O4的混合气体通入一容积为2 L的密闭容器中,反应物浓度随时间变化关系如图。下列说法不正确的是( )
N2O4(g) △H <0。在恒温条件下将一定量NO2和N2O4的混合气体通入一容积为2 L的密闭容器中,反应物浓度随时间变化关系如图。下列说法不正确的是( )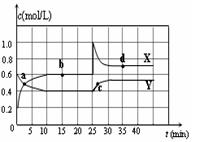
 zC(g) ΔH>0,平衡时测得A的浓度为0.50mol/L,保持温度不变,将容器的容积扩大到原来的两倍,再达平衡时, 测得A的浓度为0.30mol/L。下列有关判断正确的是
zC(g) ΔH>0,平衡时测得A的浓度为0.50mol/L,保持温度不变,将容器的容积扩大到原来的两倍,再达平衡时, 测得A的浓度为0.30mol/L。下列有关判断正确的是