题目内容
0.1mol CmHnCOOH与Br2完全加成时需Br2 16g,0.1mol该有机物完全燃烧时产生CO2和H2O的物质的量之和为3.5mol,试通过计算确定该有机酸的结构简式.
考点:有关有机物分子式确定的计算
专题:
分析:0.1mol CmHnCOOH加成时需16g溴,即n(Br2)=
=0.1mol,说明分子中含有1个C=C键;再结合根据0.1mol该羧酸完全燃烧,产生CO2和H2O共3.5mol判断其可能的结构简式.
| 16g |
| 160g/mol |
解答:
解:0.1mol CmHnCOOH加成时需16g溴,即n(Br2)=
=0.1mol,说明分子中含有1个C=C键,
所以n+1=2(m+1)-2,即n=2m-1,
0.1mol该有机物 CmHnCOOH完全燃烧时,生成二氧化碳为:0.1(m+1)mol,生成水为:0.05(n+1)mol,产生CO2和H2O的物质的量之和为3.5mol,则:0.05(n+1)mol+0.1(m+1)mol=3.5mol,即:0.5n+m=33.5,联立n=2m-1,可得m=17,n=33,
该有机酸的分子式为:C17H33COOH,
答:该有机物的结构简式为C17H33COOH.
| 16g |
| 160g/mol |
所以n+1=2(m+1)-2,即n=2m-1,
0.1mol该有机物 CmHnCOOH完全燃烧时,生成二氧化碳为:0.1(m+1)mol,生成水为:0.05(n+1)mol,产生CO2和H2O的物质的量之和为3.5mol,则:0.05(n+1)mol+0.1(m+1)mol=3.5mol,即:0.5n+m=33.5,联立n=2m-1,可得m=17,n=33,
该有机酸的分子式为:C17H33COOH,
答:该有机物的结构简式为C17H33COOH.
点评:本题考查有机物结构简式的确定,题目难度中等,明确有机物质的燃烧规律是解题的关键,注意掌握常见有机物结构与性质.

练习册系列答案
 暑假作业暑假快乐练西安出版社系列答案
暑假作业暑假快乐练西安出版社系列答案
相关题目
汽车尾气净化中的一个反应如下:NO(g)+CO(g)?
N2(g)+CO2 (g)△H=-373.4kJ.mol-1若反应在恒容的密闭容器中达到平衡状态,下列有关说法正确的是( )
| 1 |
| 2 |
| A、其它条件不变,加入催化剂,△H变大 |
| B、及时除去二氧化碳,正反应速率加快 |
| C、降低温度,可提高反应物的转化率 |
| D、若气体的密度保持不变,说明平衡不发生移动 |
 某制糖厂以甘蔗为原料制糖,同时得到大量的甘蔗渣,对甘蔗渣进行综合利用不仅可以提高经济效益,而且还能防止环境污染,现按下列方式进行综合利用.
某制糖厂以甘蔗为原料制糖,同时得到大量的甘蔗渣,对甘蔗渣进行综合利用不仅可以提高经济效益,而且还能防止环境污染,现按下列方式进行综合利用.
 (B2H6为乙硼烷)
(B2H6为乙硼烷) 合成
合成 (部分试剂和反应条件已去).请回答下列问题:
(部分试剂和反应条件已去).请回答下列问题: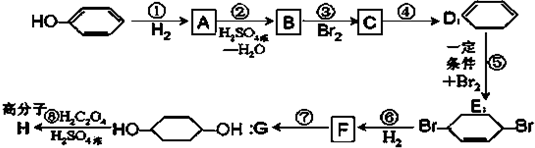
 ,写出在同样条件下CH2=CH-CH=CH2与等物质的量Br2发生加成反应的化学方程式:
,写出在同样条件下CH2=CH-CH=CH2与等物质的量Br2发生加成反应的化学方程式: 的化学方程式(有机物写结构简式,注明反应条件).
的化学方程式(有机物写结构简式,注明反应条件). ,其PMR谱中有2个信号峰,其强度之比为3:1.则下列有机物分子中,在质子核磁共振谱中能给出三种峰(信号)且强度之比为1:1:2的是
,其PMR谱中有2个信号峰,其强度之比为3:1.则下列有机物分子中,在质子核磁共振谱中能给出三种峰(信号)且强度之比为1:1:2的是 B.
B. C.
C. D.
D.

 的合成路线流程图.
的合成路线流程图.
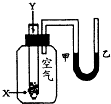 某学生用如右图所示的装置进行化学反应X+2Y→2Z能量变化情况的研究.当往试管中滴加试剂Y时,看到试管中甲处液面下降,乙处液面上升.关于该反应的下列叙述正确的是( )
某学生用如右图所示的装置进行化学反应X+2Y→2Z能量变化情况的研究.当往试管中滴加试剂Y时,看到试管中甲处液面下降,乙处液面上升.关于该反应的下列叙述正确的是( )