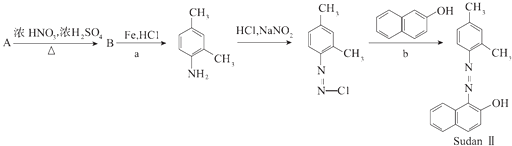
��Ŀ����
����Ŀ������A��B��C��D��E����ǿ����ʣ�������ˮ�пɵ�������������ӣ��������Ӳ��ظ�����
������ | H+��Na+��A13+��Ag+��Ba2+ |
������ | OH����Cl����CO |
��֪����A��B����Һ�ʼ��ԣ�C��D��E��Һ�����ԣ�
��A��Һ��E��Һ��Ӧ�����������г���������A��Һ��C��Һ��Ӧֻ�����������
��D��Һ������������Һ��Ӧ���ܲ���������Cֻ����D��Ӧ����������
�������������������������
��1����C��Һ��μ��������������ʵ�����Ũ�ȵ�A��Һ�У���Ӧ����Һ�и�������Ũ���ɴ�С��˳��Ϊ�� ��
��2��д��E��Һ�������B��Һ��Ӧ�����ӷ���ʽ ��
��3����֪��NaOH��aq��+HNO3��aq���TNaNO3��aq��+H2O��l������H=��akJmol��1 �� ��д��B��C��ϡ��Һ��Ӧ���Ȼ�ѧ����ʽ ��
��4����100mL 0.1 molL��1E��Һ�У���μ���35 mL 2 molL��1NaOH��Һ�����յõ����������ʵ���Ϊ ��
���𰸡�
��1��c��Na+����c��Cl������c��HCO ![]() ����c��OH������c��H+����c��CO
����c��OH������c��H+����c��CO ![]() ��
��
��2��2Al3++3SO ![]() +3Ba2++8OH��=2AlO
+3Ba2++8OH��=2AlO ![]() +3BaSO4��+4H2O
+3BaSO4��+4H2O
��3��OH����aq��+H+��aq��=H2O��1����H=��akJ/mol
��4��0.01mol
���������⣺��A��B����Һ�ʼ��ԣ�������ӵĹ����֪��ӦΪBa��OH��2��Na2CO3�е�һ�֣�C��D��E��Һ�����ԣ�ӦΪAgNO3����������HCl�е�һ�֣���A��Һ��E��Һ��Ӧ�����������г���������A��Һ��C��Һ��Ӧֻ�������������AΪNa2CO3 �� BΪBa��OH��2 �� EΪAl2��SO4��3 �� CΪHCl��
��D��Һ������������Һ��Ӧ���ܲ���������Cֻ����D��Ӧ������������DΪAgNO3��1��C��A�����ʵ�����Ӧ���ɵ����ʵ�����NaCl��NaHCO3 �� ̼���������ˮ���Լ��ԣ�����Ũ�ȴ�СΪc��Na+����c��Cl������c��HCO ![]() ����c��OH������c��H+����c��CO
����c��OH������c��H+����c��CO ![]() �������Դ��ǣ�c��Na+����c��Cl������c��HCO
�������Դ��ǣ�c��Na+����c��Cl������c��HCO ![]() ����c��OH������c��H+����c��CO
����c��OH������c��H+����c��CO ![]() ������2��E��Һ�������B��Һ��Ӧ�����ӷ���ʽΪ2Al3++3SO
������2��E��Һ�������B��Һ��Ӧ�����ӷ���ʽΪ2Al3++3SO ![]() +3Ba2++8OH��=2AlO2��+3BaSO4��+4H2O��
+3Ba2++8OH��=2AlO2��+3BaSO4��+4H2O��
���Դ��ǣ�2Al3++3SO42��+3Ba2++8OH��=2AlO2��+3BaSO4��+4H2O����3�����к��ȵ��Ȼ�ѧ����ʽ��֪��B��C��ϡ��Һ��Ӧ���Ȼ�ѧ����ʽΪOH����aq��+H+��aq��=H2O��1����H=��a kJ/mol��
���Դ��ǣ�OH����aq��+H+��aq��=H2O��1����H=��a kJ/mol����4��Al2��SO4��3�����ʵ���Ϊ0.01mol��NaOH�����ʵ���Ϊ0.035L��2mol/L=0.07mol����Al3++3OH��=Al��OH��3����Al��OH��3+OH��=AlO ![]() +2H2O��֪��0.02molA13+ת��Ϊ��������NaOHΪ0.06mol��ͬʱ���ɳ���0.02mol��ʣ��0.01molNaOHֻ���ܽ�0.01mol�����������õ��ij���Ϊ0.02mol��0.01mol=0.01mol��
+2H2O��֪��0.02molA13+ת��Ϊ��������NaOHΪ0.06mol��ͬʱ���ɳ���0.02mol��ʣ��0.01molNaOHֻ���ܽ�0.01mol�����������õ��ij���Ϊ0.02mol��0.01mol=0.01mol��
���Դ��ǣ�0.01mol��

 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�����Ŀ�������ǻ�ѧѧϰ���о��ij����ֶ�,���й������ʷ������ȷ�����( )
�� | �� | �� | ������ | |
A | HNO3 | NaOH | NaCl | H2O |
B | HCl | CaO | Na2CO3 | NH3 |
C | H2SO4 | Ba(OH)2 | CO2 | Na2O2 |
D | H3PO4 | KOH | Al(OH)3 | BaSO4 |
A. AB. BC. CD. D