题目内容
3S+6KOH═2K2S+K2SO3+3H2O,氧化剂与还原剂的物质的量之比是 .
考点:氧化还原反应
专题:
分析:反应中S元素化合价升高为K2SO3中+4价,同时降低为K2S中-2价,反应中硫既作氧化剂又作还原剂,氧化剂被还原生成还原产物,还原剂被氧化生成氧化产物,根据还原产物与氧化产物的化学计量数进行判断.
解答:
解:在3S+6KOH=2K2S+K2SO3+3H2O反应中,硫元素化合价由0价升高为+4价,被氧化,硫元素由0价降低为-2价,被还原,所以硫既作氧化剂又作还原剂,氧化剂被还原生成还原产物,还原剂被氧化生成氧化产物,K2S是还原产物,K2SO3是氧化产物,根据硫元素守恒可知,氧化剂和还原剂的物质的量之比为2:1,故选B.
点评:本题考查氧化还原反应概念与计算,难度不大,根据化合价判断氧化剂与还原剂、还原产物与氧化产物是关键,也可根据电子转移守恒计算氧化剂与还原剂的物质的量之比.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
NA表示阿佛加德罗常数,下列说法正确的是( )
| A、1 mol任何气体的体积都约是22.4 L |
| B、18g NH4+含有电子数为1 mol |
| C、NA个H2SO4分子的质量与H3PO4的摩尔质量在数值上相等 |
| D、标准状况下,相同体积的O2、HCl、H2O含有的分子数相同 |
NA表示阿伏伽德罗常数,下列判断正确的是( )
| A、在20gD216O中含有10NA个电子 |
| B、标准情况下,2.24L己烷所含分子数为0.1NA |
| C、1molCl2参加反应时转移电子数一定为2NA |
| D、含NA个Na+的Na2O溶解于1L水中,Na+的物质的量浓度为1mol/L |
下列粒子在化学反应中既能表现氧化性又能表现还原性的是( )
| A、S2- |
| B、Al3+ |
| C、H2O2 |
| D、K |
下列萃取和分液结合进行的操作(用煤油为萃取剂从碘水中萃取碘)中,错误的是( )
| A、饱和碘水和煤油加入分液漏斗中后,塞上口部的塞子,且一手压住分液漏斗口部,一手握住活塞部分,把分液漏斗倒转过来用力振荡 |
| B、静置,待分液漏斗中溶液分层后,先使分液漏斗内外空气相通,以准备放出液体 |
| C、打开分液漏斗的活塞,使全部下层液体沿承接液体的烧杯内壁慢慢流出 |
| D、上层液体在分液漏斗中保存 |
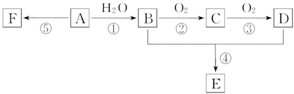 A是石油裂解气的主要成分,A的产量通常用来衡量一个国家的石油化工水平;它有如图所示的转化关系.E是有香味的有机物,F是高分子化合物.
A是石油裂解气的主要成分,A的产量通常用来衡量一个国家的石油化工水平;它有如图所示的转化关系.E是有香味的有机物,F是高分子化合物.